Каталог файлов по химии
| Главная » Статьи » Мои статьи |
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, то есть проявлять основные свойства.
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства
Комплексные соединения весьма многочисленная группа веществ. Для объяснения их строения и свойств в 1863 г. швейцарский химик А. Вернер разработал теорию, в основу которой легли представления о пространственном строении веществ (стереохимия) и теория электролитической диссоциации. Согласно этой теории комплексные, или, как их еще называют, координационные, соединения построены так: и центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы пли ионы, образовавшие с ним в основном ковалентные связи по донорно-акцепторному механизму. Они называются лигандами. Имя могут быть анионы кислот, некоторые молекулы небольшого размера, имеющие атомы с неподеленными электронными парами. Общее число лигандов. непосредственно связанных с центральным атомом, называется координационным числом. Известны комплексные соединения с координационными числами от 1 до 12 (чаще встречаются 4 и 6). Лиганды вместе с центральным атомом образуют внутреннюю сферу комплекса. При написании формул внутреннюю сферу заключают в квадратные скобки. Вокруг внутренней сферы образуется еще и внешняя сфера — из ионов, не связанных непосредственно с комплексообразователем. Внутренняя сфера участвует в химических реакциях как один многоатомный ион. внешняя сфера — как обычные ионы.
Типичное амфотерное соединение — вода, которая незначительно диссоциирует, и в присутствии кислоты ведет себя как основание, а в присутствии основания — как кислота (отдает Н+).
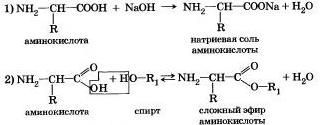
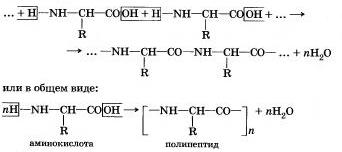
Основные свойства аминокислот проявляются в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно- акцепторному механизму. Амфотерность аминокислот проявляется в их способности в растворе образовывать в результате диссоциации диполярный ион — как бы внутреннюю соль, а самое главное, за счет амфотерности аминокислоты могут вступать друг с другом в реакции поликонденсации. образуя полипептиды и белки:
Эти процессы непрерывно протекают в клетках, обеспечивая в рибосомах биосинтез белков. Как вы уже знаете, именно порядок чередования в полученной полипептидной цепи исходных аминокислот обусловливает первичную структуру белковой молекулы.
4. Почему в алюминиевой посуде нельзя хранить щелочные растворы? Напишите уравнения возможных реакций.
| |
| Просмотров: 2504 | Рейтинг: 0.0/0 |
| Всего комментариев: 0 | |