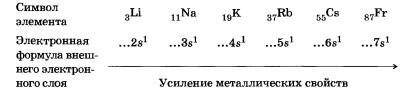Периодический закон и Периодическая система химических элементов Д. И. Менделеева и строение атома Периодический закон и Периодическая системахимических элементов Д. И. Менделеева — основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения.
Их открытие было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы. Мы будем пользоваться современными синонимами тех терминов, которые применял великий русский химик.
Предпосылки открытия Периодического закона Д. И. Менделеевым
Накопление фактологического материала
Ко времени открытия Периодического закона было известно 63 химических элемента, описаны состав и свойства их многочисленных соединений.
Работы ученых — предшественников Д. И. Менделеева
Классификация Берцелиуса. Выдающийся шведский химик Й. Я. Берцелиус разделил все элементы на металлы и неметаллы на основе различий в свойствах образованных ими простых веществ и соединений. Он определил, что металлам соответствуют основные оксиды и основания, а неметаллам — кислотныеоксиды и кислоты.
Но групп было всего две, они были велики и включали значительно отличающиеся друг от друга элементы. Наличие амфотерных оксидов и гидроксидов у некоторых металлов вносило путаницу. Классификация была неудачной.
Триады Деберейнера (1816 г.). Немецкий химик И. В. Деберейнер разделил элементы по три на основе сходства в свойствах образуемых им веществ и так, чтобы величина, которую мы сейчас понимаем как относительную атомную массу (Ат) среднего элемента, была равна среднему арифметическому двух крайних. Пример триады: Li, Nа, К.
Аr(Nа) = (7 + 39): 2 = 23 Примерами других триад могут служить:
S, Sе, Те; СІ, Вг, I.
Работа И. Деберейнера послужила подтверждением мысли о наличии определенной связи между атомными массами и свойствами элементов. Но ему удалось составить лишь четыре триады, классифицировать все известные в то время элементы он не сумел.
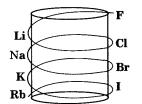
Спираль Шанкуртуа (1862 г.). Профессор Парижской высшей школы А. Бегье де Шанкуртуа предложил располагать элементы по спирали или образующей цилиндра в порядке возрастания их атомных масс и указал, что в этом случае можно заметить сходство свойств образуемых элементами веществ, если они попадают на одну и ту же вертикальную линию цилиндра, располагаясь один под другим, например:
Октавы Ньюлендса (1865 г.). Американский химик Д. А. Р. Ньюлендс пытался расположить известные ему элементы в порядке возрастания их атомных масс и обнаружил поразительное сходство между каждым восьмым по счету элементом, начиная с любого, подобно строению музыкальной октавы, состоящей из восьми звуков. Он назвал свое открытие законом октав:
[[Image:]]
Однако ему не удалось удовлетворительно объяснить найденную закономерность, более того, в его таблице не нашлось места не открытым еще элементам, а в некоторые вертикальные столбцы попали элементы, резко отличающиеся по своим свойствам. Лондонское химическое общество встретило его закон октав равнодушно и предложило Ньюлендсу попробовать расположить элементы по алфавиту и выявить какую-либо закономерность. Таблица Мейера (1864 г.). Немецкий исследователь Л. Мейер расположил химические элементы также в порядке увеличения их атомных масс:

Но в эту таблицу Мейер поместил всего 27 элементов, то есть меньше половины известных в то время. Расположение остальных элементов: В, Аl, Си, Ag и др. — оставалось неясным, а структура таблицы была неопределенной.
До Д. И. Менделеева было предпринято около 50 попыток классифицировать химические элементы. Большинство ученых пытались выявить связь между химическими свойствами элементов и их соединений и атомной массой. Но создать классификацию, включающую все известные в то время химические элементы, не удалось. Ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов и выявляющей природу их сходства и различия. Открытие Периодического закона и построение Периодической системы химических элементов — заслуга великого русского ученого Д. И. Менделеева.
В отличие от работ предшественников предложенная Д. И. Менделеевым таблица Периодической системы химических элементов имела четкую структуру в виде групп и периодов (с рядами), в которой нашлось место не только для всех известных в то время элементов, но были оставлены пустые места для еще не открытых. Система Д. И. Менделеева позволила не только предсказать существование неизвестных элементов, но и предугадать их свойства, исправить неверно определенные атомные массы уже известных элементов.
Съезд химиков в Карлсруэ
Третьей предпосылкой открытия Периодического закона послужили решения международного съезда химиков в г. Карлсруэ в 1860 г., когда окончательно утвердилось атомно-молекулярное учение, были приняты первые единые определения понятий молекулы и атома, а также атомного веса, который мы теперь называем относительной атомной массой (Аг). Именно это понятие как неизменную характеристику атомов химических элементов Д. И. Менделеев положил в основу своей классификации. Он писал: «Масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства. Поэтому ближе или естественнее всего искать зависимость между свойствами и сходствами элементов, с одной стороны, и атомными их весами — с другой».
Предшественники Д. И. Менделеева сравнивали между собой только сходные элементы, а поэтому и не смогли открыть Периодический закон. В отличие от них Д. И. Менделеев обнаружил периодичность в изменении свойств химических элементов, расположенных в порядке возрастания величин их атомных масс, сравнивая между собой все известные ему, в том числе и несходные, элементы.
Д. И. Менделеев в своем открытии опирался на четко сформулированные исходные положения:
• общее неизменное свойство атомов всех химических элементов — их атомная масса;
• свойства элементов зависят от их атомных масс;
• форма этой зависимости — периодическая.
Рассмотренные выше предпосылки можно назвать объективными, то есть не зависящими от личности ученого, так как они были обусловлены историческим развитием химии как науки.
Но без личностных качеств великого химика, которые составляют четвертую, субъективную предпосылку открытия Периодического закона, вряд ли он был бы открыт в 1869 г. Если бы его открыл какой-нибудь другой химик, вероятно, это произошло бы намного позже. Энциклопедичность знаний, научная интуиция, умение обобщать, постоянное стремление к познанию неведомого, дар научного предвидения Д. И. Менделеева сыграли свою немалую роль в открытии Периодического закона.
Открытие Д. И. Менделеевым Периодического закона
В основу своей работы по классификации химических элементов Д. И. Менделеев положил два их основных и постоянных признака: величину атомной массы и свойства. Он выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях. Сопоставляя эти сведения, ученый составил естественные группы сходных по свойствам элементов, сравнение которых между собой показало, что даже элементы несходных групп имеют объединяющие их признаки. Например, близки по значениям атомные массы фтора и натрия, хлора и калия (инертные газы еще не были известны), следовательно, щелочные металлы и галогены можно поставить рядом, выстраивая химические элементы в порядке возрастания атомных масс. Так Д. И. Менделеев объединил естественные группы химических элементов в единую систему.
Дмитрий Иванович Менделеев (1834—1907)

Великий русский ученый, один из основоположников современной химии. Создатель естественной классификации химических элементов — Периодической системы элементов, явившейся выражением Периодического закона химических элементов. Создал фундаментальный труд — учебник «Основы химии», в котором впервые вся неорганическая химия изложена на основе Периодического закона. Он автор химической теории растворов. В своих трудах много внимания уделял развитию отечественной промышленности и химизации сельского хозяйства.
Д. И. Менделеев доказывал необходимость создания химических производств: соды, серной кислоты, минеральных удобрений. Обосновывал идеи подземной газификации угля и применение кислорода в металлургической промышленности. Предложил способ непрерывной переработки нефти, а также оригинальную теорию ее происхождения.
При этом он обнаружил, что свойства элементов изменяются в пределах определенных их совокупностей линейно (монотонно возрастают или убывают), а затем повторяются периодически, то есть через определенное число элементов встречаются сходные. Ученый выделил периоды, в которых свойства химических элементов и образованных ими веществ закономерно изменяются. Рассмотрим эти изменения, используя современные термины.
1. Металлические свойства простых веществ, наиболее ярко выраженные у щелочных металлов, ослабевают и сменяются неметаллическими, которые наиболее ярко выражены у галогенов.
2. Значение степени окисления атомов элементов в высших оксидах возрастает от +1 до +7 (+8 только для Оs и Ru).
3. Значение степени окисления атомов элементов в гидридах (соединениях металлов с водородом) и в летучих водородных соединениях возрастает сначала от +1 до +3 и затем от -4 до -1.
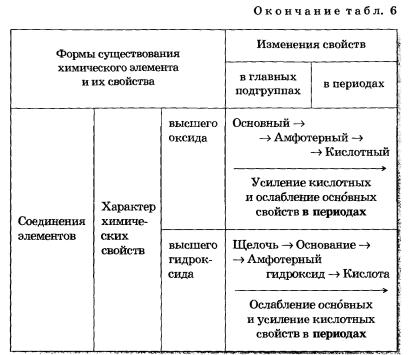
4. Основные оксиды элементов начала периода сменяет амфотерный оксид и далее — кислотные, свойства которых усиливаются.
5. Гидроксиды-основания через амфотерный гидроксид сменяются все более сильными кислотами.
На основании этих наблюдений Д. И. Менделеев сформулировал Периодический закон, который в соответствии с принятой в настоящее время терминологией звучит так:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их относительных атомных масс.
Днем рождения великого закона считается 1 марта 1869 г.
Для иллюстрации этого закона мы использовали рассмотренные периодичности (дискретности, прерывистости через определенные промежутки) только по горизонтали. Однако Периодический закон и Периодическая система гораздо более богаты периодическими закономерностями: кроме рассмотренной горизонтальной (по периодам) периодичности есть также периодичность вертикальная (по группам) и диагональная.
Вам уже хорошо знакома вертикальная периодичность: в группах (главных подгруппах) с ростом порядковых номеров элементов усиливаются металлические свойства образуемых ими простых веществ и ослабевают неметаллические свойства; усиливается основный характер оксидов и гидроксидов; уменьшается прочность летучих водородных соединений и соответственно увеличиваются их кислотные свойства.
Под диагональной периодичностью понимают повторяемость сходства химических свойств простых веществ и соединений элементов, расположенных по диагонали друг от друга в Периодической системе.
Сходство в свойствах между простыми веществами и соединениями, образованными химическими элементами, расположенными по диагонали, объясняется тем, что нарастание неметаллических свойств в периодах слева направо приблизительно уравновешивается эффектом увеличения металлических свойств в группах сверху вниз.
Например, металл литий Li похож на магний во всем, что отличает его от натрия Na. Аналогично бор В больше напоминает кремний чем алюминий Аl.
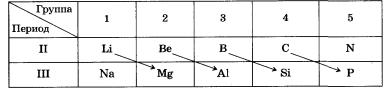
К числу общих химических свойств у Li и Mg следует отнести их способность легко воспламеняться, неустойчивость их нитратов и карбонатов, малую растворимость в воде фторидов, фосфатов и силикатов.
Диагональное сходство Ве и Аl выражается в том, что оба металла одинаково реагируют с кислотами и щелочами, а их оксиды и гидроксиды амфотерны.
Бор и кремний образуют похожие простые вещества, которые инертны и тугоплавки, а оксиды и гидроксиды обладают кислотными свойствами. Бор, подобно углероду и кремнию, образует летучие водородные соединения, по способам получения и свойствам аналогичные кремневодородам (силанам): В2Н6, В4Н10 и т. д.
Лучше всего диагональную периодичность свойств неметаллов характеризует хорошо известная вам диагональ В — Si— As— Те — Аt, которая условно делит элементы на металлы и неметаллы, или диагональ С — Р — Sе — I.
Две диагонали: Аl — Gе — Sb и Zn — In — РЬ — включают элементы, оксиды и гидроксиды которых обладают амфотерными свойствами.
Если объединить горизонтальную, вертикальную и диагональную периодичности, то можно получить «звездную периодичность».
Именно учет всех видов периодичности позволил Д. И. Менделееву не только предсказать, описать свойства веществ, образованных еще не открытыми химическими элементами, но и указать пути их открытия, природные источники (руды и соединения), из которых могли быть получены соответствующие простые вещества.
Периодический закон и строение атома
Формулировка закона, данная Д. И. Менделеевым, не могла быть точной и полной с современной точки зрения, так как она соответствовала состоянию науки на тот период времени, когда не было известно строение атома. Поэтому новые научные открытия вступили с ней в противоречие. Так, были открыты изотопы.
Изотопы — разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа.
Сумму чисел протонов и нейтронов в ядре атома называют массовым числом и обозначают буквой А.
Очевидно, что ядра изотопов одного химического элемента имеют одинаковое число протонов, но различаются числом содержащихся в них нейтронов. Следовательно,
химический элемент — это вид атомов, характеризующихся одинаковым зарядом ядра, то есть содержащих одинаковое число протонов.
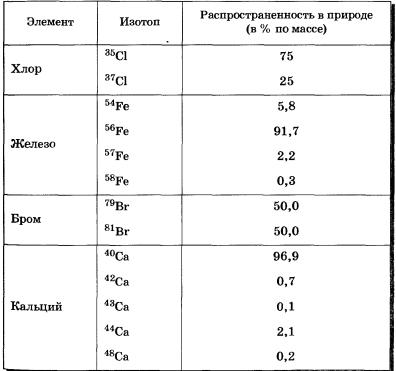
Изотопы известны для всех химических элементов. В природе большинство их существует в виде смеси изотопов. Относительная атомная масса элемента равна среднему значению относительных атомных масс всех его природных изотопов с учетом их распространенности.
Данные об изотопах некоторых химических элементов приведены в таблице 5, указаны их массы и процентное содержание в природе (по массе).
В таблице Периодической системы под символами химических элементов приведены средние значения их относительных атомных масс. Их можно рассчитать, зная массовое число каждого изотопа и массовую долю его в природной смеси. Так,
Аr (Сl) = 35 • 0,75 + 37 • 0,25 = 35,5
Таблица 5 Изотопы некоторых химических элементов
Наличие изотопов доказывает, что свойства химических элементов определяются не столько их атомной массой, как предполагал Д. И. Менделеев, сколько зарядом атомных ядер. Этим и объясняется положение в Периодической системе четырех пар элементов, размещенных с нарушением принципа возрастания относительных атомных масс:
18Аг (39,948) — 19К (39,102) 27Со (58,933) — 28№ (58,71) 52Те (127,60) — 531 (126,904) 90ТЬ (232,038) — 91Ра (231)
В том-то и гениальность, проявление научной интуиции великого русского химика, что он в указанных случаях предпочел расположить элементы по сходству в свойствах, предугадал истинный порядок размещения химических элементов по возрастанию зарядов их атомных ядер, хотя о строении их атомов ничего не знал.
Впервые физический смысл порядкового (атомного) номера раскрыл голландец Ван-ден-Брук, который теоретически доказал, что порядковый номер химического элемента равен заряду ядра его атома. Гипотеза Ван-ден-Брука была экспериментально подтверждена англичанином Г. Мозли.
Открытие изотопов и закономерность Ван-ден-Брука— Мозли позволили дать другое, современное определение Периодического закона:
Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодическая система химических элементов и строение атома
Таблица Периодической системы химических элементов графически отображает Периодический закон. Каждое число в ней характеризует какую-либо особенность в строении атомов:
а) порядковый (атомный) номер химического элемента указывает на заряд его атомного ядра, то есть на число протонов, содержащихся в нем, а так как атом электронейтрален, то и на число электронов, находящихся вокруг атомного ядра. Число нейтронов определяют по формуле
N = A - Z
где А — массовое число, Z — порядковый номер элемента;
б) номер периода соответствует числу энергетических уровней (электронных слоев) в атомах элементов данного периода;
в) номер группы соответствует числу электронов на внешнем уровне для элементов главных подгрупп и максимальному числу валентных электронов для элементов побочных подгрупп.
В свете строения атома можно объяснить причины изменения свойств химических элементов и образованных ими веществ. В периоде с увеличением зарядов атомных ядер элементов (слева направо) металлические свойства ослабевают, а неметаллические усиливаются в силу того, что:
а) возрастает число электронов на внешнем уровне атома;
б) число энергетических уровней в атомах в пределах периода остается постоянным;
в) уменьшается радиус атомов.
В группах (главная подгруппа) с увеличением зарядов атомных ядер элементов (сверху вниз) металлические свойства усиливаются, неметаллические ослабевают. Это объясняется тем, что
• число электронов на внешнем уровне атомов остается одинаковым;
• увеличивается число энергетических уровней в атоме;
• увеличивается радиус атомов.
В больших периодах такие изменения происходят медленнее, так как, начиная с третьего элемента, у атомов достраивается не внешний энергетический, а предвнешний уровень с 8 до 18 электронов (у элементов побочных подгрупп), и лишь затем заполняется внешний уровень с 2 до 8 электронов (у элементов главных подгрупп).
В «сверхбольших» периодах (шестом и седьмом, незавершенном) эти изменения происходят еще медленнее, так как у лантаноидов и актиноидов достраивается не внешний предвнешний уровень, а третий снаружи уровень — с 18 до 32 электронов. Поэтому свойства этих элементов будут так похожи на свойства элементов Lа и Ас, а также сходны между собой. Это объясняется тем, что свойства химических элементов и образуемых ими веществ зависят в первую очередь от строения внешнего энергетического уровня атомов, меньше — от строения предвнешнего и почти не зависят от строения внутренних уровней.
Природа каждого химического элемента, то есть определенные, присущие только ему свойства атомов, простых веществ, соединений зависит прежде всего от заряда ядра его атомов. Заряд обусловливает и строение электронной оболочки атома. Но величины зарядов ядер атомов химических элементов в Периодической системе Д. И. Менделеева изменяются монотонно — увеличиваются от +1 у водорода до +110 у элемента № 110, поэтому прямой причиной периодического изменения свойств элементов это явление быть не может.
Причина периодичности — изменение строения внешних электронных слоев атомов. Так, у всех щелочных металлов внешний энергетический уровень занят одним в-электро-ном, поэтому их свойства так похожи. Но они не одинаковы, степень их проявления разная, потому что этот единственный внешний электрон находится на разном удалении от ядра у атомов каждого из щелочных металлов: 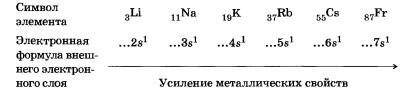
Вывод:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних электронных слоев атомов.
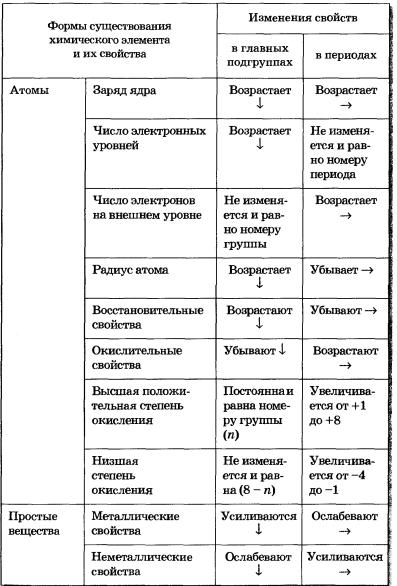
Более полные сведения о горизонтальной и вертикальной зависимостях свойств атомов, простых веществ и соединений, образованных химическими элементами, представлены в таблице 6.
Таблица 6 Изменение свойств атомов, простых веществ и соединений химических элементов
Значение Периодического закона и Периодической системы химических элементов Д. И. Менделеева
Д. И. Менделеев писал: «До периодического закона элементы представляли лишь отрывочные случайные явления природы; не было повода ждать каких-либо новых, а вновь находимые были полной неожиданной новинкой. Периодическая закономерность первая дала возможность видеть не открытые еще элементы в такой дали, до которой невооруженное этой закономерностью зрение до тех пор не достигало».
С открытием Периодического закона химия перестала быть описательной наукой — она получила инструмент научного предвидения. Этот закон и его графическое отображение — таблица Периодической системы химических элементов Д. И. Менделеева — выполнили все три важнейшие функции теоретического знания: обобщающую, объясняющую и прогностическую. На их основе ученые:
• систематизировали и обобщили все сведения о химических элементах и образуемых ими веществах;
• дали обоснование различным видам периодической зависимости, существующим в мире химических элементов, объяснив их на основе строения атомов элементов;
• предсказали, описали свойства еще не открытых химических элементов и образованных ими веществ, а также указали пути их открытия.
Систематизировать и обобщить сведения о химических элементах пришлось самому Д. И. Менделееву, когда он открывал Периодический закон, строил и совершенствовал свою таблицу. Причем ошибки в значениях атомных масс и наличие не открытых еще элементов создавали дополнительные трудности. Но великий ученый был твердо уверен в истинности открытого им закона природы. Основываясь на сходстве в свойствах и веря в правильность определения места элементов в таблице Периодической системы, он существенно изменил принятые в то время атомные массы и валентность в соединениях с кислородом у десяти элементов и «подправил» их еще у десяти других. Восемь элементов он разместил в таблице вопреки принятым в то время представлениям об их сходстве с другими. Например, таллий он исключил из естественного семейства щелочных металлов и поместил в третью группу согласно проявляемой им высшей валентности; бериллий с неверно определенной атомной массой (13) и валентностью III он перевел из третьей группы во вторую, изменив его атомную массу на 9 и высшую валентность на II.
Большинство ученых восприняли поправки Д. И. Менделеева как научное легкомыслие, необоснованную дерзость. Периодический закон и таблица химических элементов рассматривались как гипотеза, то есть предположение, нуждающееся в проверке. Ученый понимал это и именно для проверки правильности открытого им закона и системы элементов подробно описал свойства не открытых еще элементов и даже способы их открытия, исходя из предполагаемого места в системе. По первому варианту таблицы он сделал четыре прогноза (галлий, германий, гафний, скандий), а по усовершенствованному, второму — еще семь (технеций, рений, астат, франций, радий, актиний, протактиний).
За период 1869—1886 гг. были открыты три предсказанных элемента: галлий (П. Э. Лекок де Буабодран, Франция, 1875 г.), скандий (Л. Ф. Нильсон, Швеция, 1879 г.) и германий (К. Винклер, Германия, 1886 г.). Открытие первого из этих элементов, подтвердившее правильность прогноза великого русского ученого, вызвало у его коллег только интерес и удивление. Открытие же германия стало подлинным триумфом Периодического закона. К. Винклер писал в статье «Сообщение о германии»: «Не подлежит больше никакому сомнению, что новый элемент есть не что иное, как предсказанный Менделеевым за пятнадцать лет до этого экасилиций. Ибо едва ли может быть дано более убедительное доказательство справедливости учения о периодичности элементов, чем воплощение бывшего до сих пор гипотетическим экасилиция, и оно представляет собой поистине нечто большее, чем простое подтверждение смело выдвинутой теории, — оно означает выдающееся расширение химического поля зрения, могучий шаг в области познания».
На основе закона и таблицы Д. И. Менделеева были предсказаны и открыты благородные газы. И сейчас этот закон служит путеводной звездой для открытия или искусственного создания новых химических элементов. Например, можно утверждать, что элемент с № 114 будет похож на свинец (экасвинец), а № 118 будет благородным газом (экарадон).
Открытие Периодического закона и создание таблицы Периодической системы химических элементов Д. И. Менделеевым стимулировало поиск причин взаимосвязи элементов, способствовало выявлению сложной структуры атома и развитию учения о строении атома. Это учение, в свою очередь, позволило вскрыть физический смысл Периодического закона и объяснить расположение элементов в Периодической системе. Оно привело к открытию атомной энергии и использованию ее для нужд человечества.
1. Проанализируйте распределение биогенных макроэлементов по периодам и группам Периодической системы Д. И. Менделеева. Напомним, что к ним относят С, Н, О, N, Са, S, Р, К, Мg, Fе.
2. Почему элементы главных подгрупп второго и третьего периода называют химическими аналогами? В чем проявляется эта аналогия?
3. Почему водород, в отличие от всех других элементов, записывают в Периодической таблице Д. И. Менделеева дважды? Докажите правомочность двойственного положения водорода в Периодической системе, сравнив строение и свойства его атома, простого вещества и соединений с соответствующими формами существования других элементов — щелочных металлов и галогенов.
4. Почему так похожи свойства лантана и лантоноидов, актиния и актиноидов?
5. Какие формы соединений будут одинаковыми у элементов главных и побочных подгрупп?
6. Почему общие формулы летучих водородных соединений в Периодической системе пишут только под элементами главных подгрупп, а формулы высших оксидов — под элементами обеих подгрупп (посередине)?
7. Какова общая формула высшего гидроксида, соответствующего элементам VII группы? Каков его характер?
|