Альдегиды и кетоны Строение Альдегиды — органические вещества, молекулы которых содержат карбонильную группу С=0, соединенную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов имеет вид
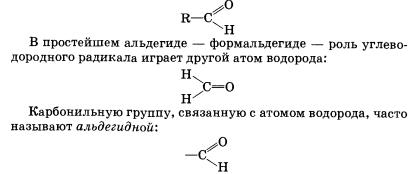
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид
O
II
R1—C—R2
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
O
II
СН3-С-СН3 ацетон Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды. В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются из названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль.
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. Поэтому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение цифрой нет необходимости.
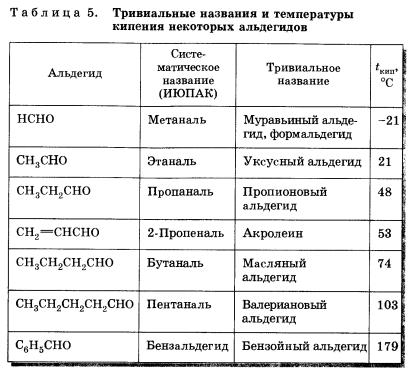
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи).
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов также и изомерия положения карбонильной группы (запишите структурные формулы изомеров бутанона и назовите их). Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Физические свойства
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь С=0 сильно поляризована за счет смещения электронной плотностип-связи к кислороду.
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов (см. табл. 5). Это связано с тем, что в молекулах альдегидов и кетонов в отличие от спиртов нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах, у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах, высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства предельных альдегидов и кетонов
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе. Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты. Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2.
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
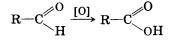
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:

Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее тонкой ровной пленкой. Получается замечательное серебряное зеркало. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосаж-денный гидроксид меди(II). Окисляя альдегид, Сu2+ восстанавливается до Сu4. Образующийся в ходе реакции гидроксид меди(I) СuОН сразу разлагается на оксид меди(I) красного цвета и воду.
Эта реакция, так же как реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Реакции присоединения
Так как в состав карбонильной группы входит двойная связь, альдегиды и кетоны способны вступать в реакции присоединения. Связь С=0 полярна, на атоме углерода сосредоточен частичный положительный заряд. Альдегиды и кетоны вступают в реакции нуклеофильного присоединения. Такие реакции начинаются с взаимодействия атома углерода карбонильной группы с свободной электронной парой нуклеофильного реагента (Nu). Затем образовавшийся анион присоединяет протон или другой катион.
При нуклеофильном присоединении синильной кислоты в присутствии следов щелочей к альдегидам и кетонам образуются оксинитрилы (циангидрины). Альдегиды и метилкетоны вступают в реакцию нуклеофильного присоединения с гидросульфитом натрия.
Образующиеся при этом гидросульфитные производные альдегидов и кетонов при нагревании с минеральными кислотами или содой разлагаются с образованием первоначальных карбонильных соединений.
Альдегиды и кетоны способны присоединять магнийорганические соединения (реактивы Гриньяра). Эти соединения получают взаимодействием металлического магния с галогеналканом в абсолютном (обезвоженном) диэтиловом эфире.
Углеводородный радикал R магнийорганического соединения, на котором сосредоточен частичный отрицательный заряд, нукле-офильно присоединяется к атому углерода карбонильной группы, а остаток МgХ — к атому кислорода:
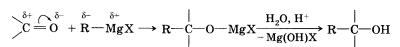
После разложения водным раствором кислоты полученного продукта образуется спирт.
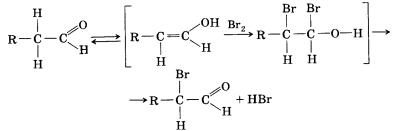
Используя эту реакцию, из формальдегида можно получить первичный спирт, из любого другого альдегида — вторичный спирт, а из кетона — третичный спирт. Например, из уксусного альдегида и этилмагнийбромида может быть получен бутанол-2. Альдегиды и кетоны реагируют с галогенами, вступая в реакцию замещения, даже в отсутствие освещения. При этом на галоген замещаются только атомы водорода при соседнем с карбонильной группой атоме углерода.
Альдегиды вступают в реакцию поликонденсации. Изучая фенолы, мы подробно рассмотрели взаимодействие метаналя (формальдегида) с фенолом, приводящее к образованию фенол-формальдегидных смол.
Способы получения
Альдегиды и кетоны могут быть получены окислением или дегидрированием спиртов. Еще раз отметим, что при окислении или дегидрировании первичных спиртов могут быть получены альдегиды, а вторичных спиртов — кетоны.
Из ацетилена в результате реакции получается уксусный альдегид, из гомологов ацетилена — кетоны:
Отдельные представители альдегидов и их значение
Формальдегид, (метаналь, муравьиный альдегид) НСНО — бесцветный газ с резким запахом и температурой кипения -21 °С, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде (40%) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид) СН3СНО — жидкость с резким, неприятным запахом и температурой кипения 21 °С, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
1. Сколько атомов углерода содержится в молекуле простейшего альдегида? в молекуле простейшего кетона? Назовите эти вещества. Приведите синонимы их названий.
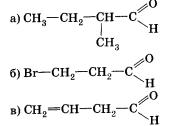
2. Назовите вещества, структурные формулы которых следующие:
3. Составьте структурные формулы изомеров бутаналя. К каким классам относятся эти вещества? Назовите их. Составьте уравнения реакций гидрирования этих соединений и укажите названия продуктов реакций.
4. Какой объем формальдегида (н. у.) необходимо подвергнуть гидрированию для получения 16 г метилового спирта?
5. Составьте уравнение реакции гидрирования диметилкето-на (ацетона). Какова молярная масса продукта реакции?
6. Запишите уравнение реакции «серебряного зеркала» с участием метаналя. Какие функциональные группы содержит молекула карбоновой кислоты — продукта этой реакции? Может ли она окисляться аммиачным раствором оксида серебра? Что может образовываться при этом? Проиллюстрируйте свой ответ уравнениями реакций.
7. В ходе реакции «серебряного зеркала» образовалась карбоновая кислота, имеющая относительную молекулярную массу, равную 88. Какие органические вещества могли быть реагентами в этой реакции? Используя структурные формулы, составьте возможные уравнения этой реакции.
8. Какая масса ацетальдегида необходима для восстановления 0,54 г серебра из его оксида? Какое количество гидроксида калия необходимо для нейтрализации образующейся при этом уксусной кислоты?
9. В одном из сосудов находится раствор ацетона, в другом — ацетальдегида. Предложите способы определения содержимого каждого сосуда.
10. Какие вещества образуются при нагревании гидроксида меди(ІІ) с пропаналем? Подтвердите ответ уравнением реакции. Каковы признаки этой реакции?
11. При сгорании 4,5 г органического вещества образовалось 3,36 л (н. у.) углекислого газа и 2,7 мл воды. Определите простейшую и истинную формулу вещества, если его плотность по воздуху равна 1,035. Объясните этимологию названий этого вещества. Каковы области его применения?
12*. Составьте уравнения реакций, которые могут протекать при бромировании пропаналя на свету. Какие продукты могут образовываться при этом? Назовите их. Какие продукты образуются при взаимодействии пропаналя с подкисленной бромной водой? Назовите их.
13*. При окислении 11,6 г кислородсодержащего органического соединения образовалось 14,8 г одноосновной карбоновой кислоты, при взаимодействии которой с избытком гидрокарбоната натрия выделилось 4,48 л (н. у.) газа. Определите строение исходного соединения.
14*. При окислении 1,18 г смеси муравьиного и уксусного альдегидов избытком аммиачного раствора оксидасеребра образовалось 8,64 г осадка. Определите массовые доли альдегидов в смеси.
| 






