Простые углеводы Глюкоза и фруктоза — твердые бесцветные кристаллические вещества. Глюкоза содержится в соке винограда (отсюда название «виноградный сахар») вместе с фруктозой, которая содержится в некоторых фруктах и плодах (отсюда название «фруктовый сахар»), составляет значительную часть меда. В крови человека и животных постоянно содержится около 0,1% глюкозы (80—120 мг в 100 мл крови). Большая ее часть (около 70%) подвергается в тканях медленному окислению с выделением энергии и образованием конечных продуктов — углекислого газа и воды (процесс гликолиза):
гликолиз
С6Н1206 + 602---------> 6С02 + 6Н20 + 2920 кДж
Энергия, выделяемая при гликолизе, в значительной степени обеспечивает энергетические потребности живых организмов.
Превышение содержания глюкозы в крови уровня 180 мг в 100 мл крови свидетельствует о нарушении углеводного обмена и развитии опасного заболевания — сахарного диабета.
Строение молекулы глюкозы
О строении молекулы глюкозы можно судить на основании опытных данных. Она реагирует с карбоновыми кислотами, образуя сложные эфиры, содержащие от 1 до 5 остатков кислоты. Если раствор глюкозы прилить к свежеполученному гидроксиду меди(П), то осадок растворяется и образуется ярко-синий раствор соединения меди, т. е. происходит качественная реакция на многоатомные спирты. Следовательно, глюкоза является многоатомным спиртом. Если же подогреть полученный раствор, то вновь выпадет осадок, но уже красноватого цвета, т. е. произойдет качественная реакция на альдегиды. Аналогично если раствор глюкозы нагреть с аммиачным раствором оксида серебра, то произойдет реакция «серебряного зеркала». Следовательно, глюкоза является одновременно многоатомным спиртом и альдегидом — альдегидо-спиртом. Попробуем вывести структурную формулу глюкозы. Всего атомов углерода в молекуле С6Н1206 шесть. Один атом входит в состав альдегидной группы: —С= O .
\
Н
Остальные пять атомов связываются с пятью гидрокси-группами.
И наконец, атомы водорода в молекуле распределим с учетом того, что углерод четырехвалентен. Однако установлено, что в растворе глюкозы, помимо линейных (альдегидных) молекул, существуют молекулы циклического строения, из которых состоит кристаллическая глюкоза. Превращение молекул линейной формы в циклическую можно объяснить, если вспомнить, что атомы углерода могут свободно вращаться вокруг о-связей, расположенных под углом 109°28'. При этом альдегидная группа (1-й атом углерода) может приблизиться к гидроксильной группе пятого атома углерода. В первой под влиянием гидроксигруппы разрывается тг-связь: к атому кислорода присоединяется атом водорода и «потерявший» этот атом кислород гидроксигруппы замыкает цикл.
В результате такой перегруппировки атомов образуется циклическая молекула. Циклическая формула показывает не только порядок связи атомов, но и их пространственное расположение. В результате взаимодействия первого и пятого атомов углерода появляется новая гидроксигруппа у первого атома, которая может занять в пространстве два положения: над и под плоскостью цикла, а потому возможны две циклические формы глюкозы: а) а-форма глюкозы — гидроксильные группы при первом и втором атомах углерода расположены по одну сторону кольца молекулы и б) 3-форма глюкозы — гидроксильные группы находятся по разные стороны кольца молекулы.
В водном растворе глюкозы в динамическом равновесии находятся три ее изомерные формы — циклическая а-форма, линейная (альдегидная) форма и циклическая ß-форма:
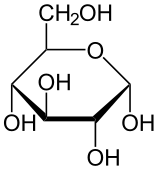 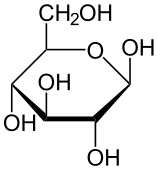
а-форма ß-форма
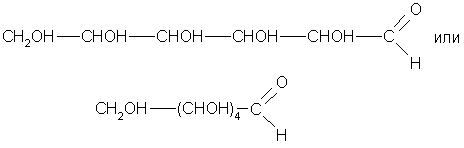
Линейная молекула В установившемся динамическом равновесии преобладает р-форма (около 63%), так как она энергетически предпочтительнее — у нее ОН-группы у первого и второго углеродных атомов по разные стороны цикла. У а-формы (около 37%) ОН-группы у тех же углеродных атомов расположены по одну сторону плоскости, поэтому она энергетически менее устойчива, чем р-форма. Доля же линейной формы в равновесии очень мала (всего около 0,0026%).
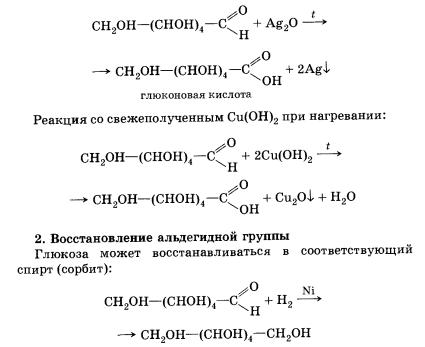
Динамическое равновесие можно сместить. Например, при действии на глюкозу аммиачного раствора оксида серебра количество ее линейной (альдегидной) формы, которой в растворе очень мало, пополняется все время за счет циклических форм, и глюкоза полностью подвергается окислению до глю-коновой кислоты.
Изомером альдегидоспирта глюкозы является кетоноспирт — фруктоза:
СН2ОН—(СНОН)3—С—СН2ОН ll О 
Химические свойства глюкозы
Химические свойства глюкозы, как и любого другого органического вещества, определяются ее строением. Глюкоза обладает двойственной функцией, являясь и альдегидом, и многоатомным спиртом, поэтому для нее характерны свойства и многоатомных спиртов, и альдегидов.
Реакции глюкозы как многоатомного спирта
Глюкоза дает качественную реакцию многоатомных спиртов (вспомните глицерин) — со свежеполученным гидроксидом меди(II), образуя ярко-синий раствор соединения меди(II).
Глюкоза, подобно спиртам, может образовывать сложные эфиры.
Реакции глюкозы как альдегида
1. Окисление альдегидной группы
Глюкоза как альдегид способна окисляться в соответствующую (глюконовую) кислоту и давать качественные реакции альдегидов:
Реакция «серебряного зеркала»:
Реакции брожения
Эти реакции протекают под действием особых биологических катализаторов белковой природы —ферментов. Из различных видов брожения отметим: 1. Спиртовое брожение
дрожжи
С6Н1206 --------> 2С2Н5ОН + 2С02
издавна применяемое человеком для получения этилового спирта и алкогольных напитков.
2. Молочнокислое брожение
С6Н1206 —> 2СН3—СН—СООН, l ОН
молочная кислота
которое составляет основу жизнедеятельности молочнокислых бактерий и происходит при скисании молока, квашении капусты и огурцов, силосовании зеленых кормов.
Применение глюкозы
Глюкоза является основным источником энергии в живой клетке, поэтому она широко применяется в медицине при лечении самых различных заболеваний, особенно при общем истощении организма. Полученный восстановлением глюкозы сорбит используется при диабете в качестве заменителя сахара.
В микробиологической промышленности растворы глюкозы применяют как питательную среду для размножения кормовых дрожжей. Спиртовым брожением глюкозы получают пищевой этиловый спирт.
В кондитерской промышленности глюкоза в составе патоки используется при изготовлении мармелада, карамели, пряников и т. п.
Реакция «серебряного зеркала» глюкозы применяется при изготовлении зеркал и елочных украшений.
В текстильной промышленности глюкоза используется для отделки тканей.
Для всех этих целей глюкозу получают из крахмала, подвергая его гидролизу в присутствии минеральных кислот.
1. Какие свойства глюкозы позволяют делать выводы о строении ее молекулы?
2. Используя структурную формулу глюкозы (в линейной форме), составьте уравнения реакций ее взаимодействия с аммиачным раствором оксида серебра, гидроксидом меди(ІІ), гидроксидом меди(ІІ) при нагревании и с избытком уксусной кислоты.
3. Составьте уравнение реакции гидрирования глюкозы. В какой форме молекула глюкозы может принимать участие в этой реакции? Назовите продукт присоединения и класс органических веществ, к которому он относится.
4. Можно ли считать линейную и циклическую формы глюкозы изомерами? Объясните ответ.
5. Какие особенности строения молекулы фруктозы позволяют назвать ее кетоноспиртом?
6. Характерна ли для фруктозы реакция «серебряного зеркала»? Почему?
7. Составьте уравнения реакций спиртового и молочнокислого брожения глюкозы с использованием структурных формул. Назовите продукты реакций.
8. Расскажите о биологической роли глюкозы. На чем основано ее применение в медицине и промышленности?
9. При молочнокислом брожении 144 кг глюкозы получили 120 кг молочной кислоты. Какова массовая доля выхода молочной кислоты от теоретически возможного?
10. В процессе фотосинтеза зеленые растения нашей планеты ежегодно поглощают 200 млрд т углекислого газа. Какой объем кислорода выделяется в атмосферу при этом?
11. Сколько глюкозы (в мг) можно окислить аммиачным раствором оксида серебра, если он содержит: а) 20,88 мг Аg2O; б) 1,5 ммоль Аg2O?
| 






