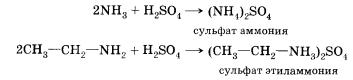Амины Строение
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеводородным остатком.
Соответственно обычно выделяют три типа аминов:
СН3—NH2
первичный амин метиламин
CH3CH2—NH—CH2CH3
вторичный амин диэтиламин
H3CH2—N—CH2CH3
|
СН9СН3
третичный амин триэтиламин
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную группу NH2 — аминогруппу.
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин. Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония.
Эти ионы входят в состав солей, похожих на соли аммония. Они называются четвертичными аммонийными солями.
Изомерия и номенклатура
Для аминов характерна структурная изомерия:
• изомерия углеродного скелета
• изомерия положения функциональной группы
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия).
Как видно из приведенных примеров, для того чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс -амин.
Получение
1. Получение аминов из галогенопроизводных
СН3СН2Вг + NН3 —> СН3СН2NH3Вг
В результате этой реакции образуется соль амина (гидробромид этиламмония), из которой действием щелочи можно выделить первичный амин (этиламин):
СН3СН2NН3Вг- + NаОН —> NаВг + СН3СН2МН2 + Н20
этиламин
При взаимодействии полученного первичного амина и галогено-производного и последующей обработке щелочью получают вторичный амин (диэтиламин):
СН3СН2Вг + СН3СН2NН2 —> (СН3СН2)21NH2Вг-
(СН3СН2)2NН2Вг +NaOН —> NaВг + СН3СН2КНСН2СН3 + Н20
диэтиламин
Повторение процедуры приводит к образованию третичного амина:
СН3СН2Вг + СН3СН21NНСН2СН3 —> (СН3СН2)31ЧН+Вг-(СН3СН2)3NНВг- 4- NаОН —> NаВг + (СН3СН2)3К + Н20
Третичный амин может еще раз вступить в реакцию с бромэта-ном. При этом образуется четвертичная аммонийная соль, образованная бромид-ионом и катионом тетраэтиламмония:
(СН3СН2)3N + СН3СН2Вг —> [(СН3СН2)41N]+Вг-
Зинин Николай Николаевич (1812-1880)

Русский химик-органик, академик. Открыл (1842) реакцию восстановления ароматических нитросоединений и получил анилин. Доказал, что амины — основания, способные образовывать соли с различными кислотами. Синтезировал и изучал многие другие органические вещества. 2. Получение первичных аминов восстановлением нитросоединений — алифатических и ароматических. Восстановителем является водород «в момент выделения», который образуется при взаимодействии, например, цинка со щелочью или железа с соляной кислотой.
В промышленности анилин (аминобензол), важнейшее соединение, которое применяют для получения красителей, лекарств, пластических масс, также получают восстановлением нитробензола, нагревая в присутствии железа с водяным паром. Способ получения анилина из нитробензола был предложен русским химиком Н. Н. Зининым.
Физические свойства аминов
Простейшие амины (метиламин, диметиламин, триметил-амин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но неспособными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184 °С.
Химические свойства
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
1. Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т. е. выступать в роли основания.
Как вы уже знаете из курса неорганической химии, реакция аммиака с водой приводит к образованию гидроксид-ионов. Раствор аммиака в воде имеет щелочную реакцию. Растворы аминов в воде также дают щелочную реакцию.
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
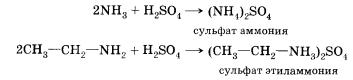
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Это связано с наличием одного и более до-норных алкильных заместителей, положительный индуктивный эффект которых повышает электронную плотность на атоме азота. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства.

При нагревании аммониевой соли карбоновой кислоты происходит дегидратация и образуется амид. В случае ароматических аминов аминогруппа и бензольное кольцо оказывают существенное влияние друг на друга.
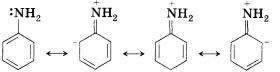
Аминогруппа является ориентантом первого рода. Аминогруппа обладает отрицательным индуктивным эффектом и выраженным положительным мезомерным эффектом. Таким образом, реакции электрофильного замещения (броми-рование, нитрование) будут приводить к орто- и пара-замещенным продуктам.
Обратим внимание, что в отличие от бензола, который бро-мируется только в присутствии катализатора — хлорида железа(III), анилин способен реагировать с бромной водой. Это объясняется тем, что аминогруппа, повышая электронную плотность в бензольном кольце (вспомните аналогичное влияние заместителей в молекулах толуола и фенола), активизирует ароматическую систему в реакциях электрофильного замещения. Кроме того, анилин, в отличие от бензола, немного растворим в воде.
Сопряжение п-системы бензольного кольца с неподеленной электронной парой аминогруппы приводит к тому, что анилин является существенно более слабым основанием, чем алифатические амины.
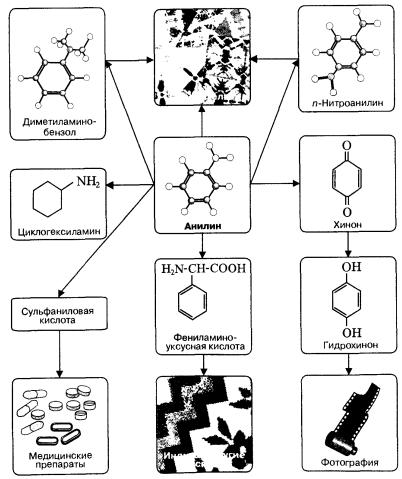
Применение аминов
Амины широко применяются для получения лекарств, полимерных материалов. Анилин — важнейшее соединение данного класса (схема 11), которое используют для производства анилиновых красителей, лекарств (сульфаниламидных препаратов), полимерных материалов (анилиноформальдегидных смол).
Схема 11. Применение анилина
1. Приведите по три структурные формулы первичных, вторичных и третичных аминов. Назовите их.
2. Составьте структурные формулы изомеров пропилэтил-амина. К каким типам органических соединений относятся эти вещества? Дайте их названия.
3. Как влияет способность образовывать водородные связи на физические свойства аминов?
4. Найдите массу 19,6%-ного раствора серной кислоты, способного прореагировать с 11,2 л метиламина (н. у.) с образованием средней соли.
5. Составьте схему получения диэтиламина из этена и неорганических веществ. Запишите уравнения реакций.
6. Объясните, почему основные свойства анилина выражены слабее, чем у аммиака и алифатических аминов.
7. При добавлении к бромной воде анилина она обесцвечивается. Объясните изменения и приведите уравнения реакций.
8*. Через смесь анилина, бензола и фенола массой 100 г пропустили сухой хлороводород. При этом образовалось 51,8 г осадка, который отфильтровали. Фильтрат обработали бромной водой, при этом получили 19,9 г осадка. Определите массовые доли веществ в исходной смеси.
9*. К смеси объемом 7 л, состоящей из углекислого газа и метиламина, добавили 5 л бромоводорода, после чего плотность газовой смеси по воздуху стала 1,942. Вычислите объемные доли газов в исходной смеси.
10*. Приведите пример реакции нуклеофильного замещения с участием первичного и вторичного аминов.
|