Скорость химических реакций
Химические реакции протекают с разными скоростями. Очень быстро проходят реакции в водных растяп рах. практически мгновенно. Смешаем растворы хлориде бария и сульфата натрия — сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно горят сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, иллет на медных и бронзовых изделиях, гниет листва, разрушаются зубы.
Предсказание скорости химической реакции, а также выяснение ее зависимости от условий проведения процесса — задача химической кинетики ~ науки о закономерностях протекания химических реакций во времени.
Если химические реакции происходят в однородной среде, например и растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всем объеме. Такие реакции, как вы знаете, называют гомогенными.
Скорость гомогенной реакции определяется как изменение количества вещества в единицу времени в единице объема:
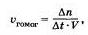
— изменение числа молей одного из веществ (чаще всего исходного, ко может быть и продукта реакции);
— интервал времени (с, мин);
— объем газа или раствора (л).
Поскольку отношение количества веществ к объему представляет собой молярную концентрацию С, то
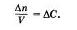
Таким образом, скорость гомогенной реакции определя ется как изменение концентрации одного из веществ в единицу времени:
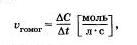
если объем системы не меняется.
Вели реакция идет между веществами, находящимися в разных агрегатных состояниях (например, между твердым веществом и газом или жидкостью) пли между веществами, неспособными образовывать гомогенную среду (например, между несмешивающимися жидкостями), то она проходит только на поверхности соприкосновения веществ. Такие реакции, как вы также знаете, называют гетерогенными.
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности.
Если при какой-либо протекающей реакции экспериментально измерять концентрацию исходного вещества в разные моменты времени, то графически можно отобразить ее изменение с помощью кинетической кривой для этого реагента.
Скорость реакции не является постоянной величиной. Мы указываем лишь некоторую среднюю скорость данной реакции в определенном интервале времени
Представьте себе, что мы определяем скорость реакции:
Н2 + Сl2 —> 2НСl
а) по изменению концентрации Н2.
б) по иаыенеиню концентрации HCl.
Одинаковые ли мы получим значения? Ведь из 1 моль H2 образуется 2 моль HCl, поэтому и скорость в случае б) окажется больше в два раза. Следовательно, значение скорости реакции зависит и от того, по какому веществу ее определяют.
Изменение количества вещества, по которому определяют скорость реакции, — это внешний фактор, наблюдаемый исследователем. По сути, все процессы осуществляются на микроуровне. Очевидно, для того чтобы какие-то частицы прореагировали, они прежде всего должны столкнуться. Причем столкнуться эффективно: не разлететься как мячики в разные стороны, а так, чтобы в частицах разрушились или ослабли •старые связи» и смогли образоваться «новые», а для этого частицы должны обладать достаточной энергией.
Расчетные данные показывают, что. например, в газах частота столкновений молекул при атмосферном давленый исчисляется миллиардами за I секунду, то есть все реакции должны были бы идти мгновенно. Но ведь это не так! Оказывается, что лишь очень небольшая доля молекул обладает необходимой энергией, приводящей к эффективному соударению.
Минимальный избыток энергии, который должна иметь частица (или пара частиц), чтобы произошло эффективное соударение, называют энергией активации Г.
Таким образом, на пути всех частил, вступающих в реакцию, имеется энергетический барьер, равный энергии активации £и. Когда он маленький, то находится много частиц, которые могут его преодолеть, к скорость реакции велика. В противном случае требуется «толчок». Когда вы подносите спичку, чтобы зажечь спиртовку, вы сообщаете дополнительную энергию Ев, необходимую для эффективного соударения молекул спирта с молекулами кислорода (преодоления барьера).
Обратимся к реакции взаимодействия двух газообразных веществ — водорода (Н2) и иода (I2):
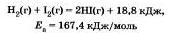
Это экзотермическая реакция. Значение Е, находится экспериментально.
Чем же определяется значение энергии активации? Как она связана с природой реагирующих веществ? Можно ли по анергии активации суд1гть о возможном механизме реакции?
Для перехода нэ исходного состояния в конечное состояние молекулы должны столкнуться эффективно. Реагируют только частицы, обладающие достаточной энергией, то есть активные частицы. Для перехода в активное состояние (преодоления определенного онергетического барьера) затрачивается К. Активные частицы сталкиваются и образуют промежуточное активное вещество.
Это переходное состояние называют активированным комплексом. В нем одновременно разрываются старые связи Н—Н и I—I и начиняют образовываться новые химические связи Н I. Такие комплексы существуют недолго, их распад приводит к образованию продукта реакции.
Энергия, затраченная на активацию молекул, выделяется при образования продуктов реакции. Процесс образования иодоводорода обратим.
Это эндотермическая реакция.
Обратная реакция также протекает через промежуточное состояние — образование активированного комплекса.
Обратите внимание на то, что Еп для эндотермической реакции больше Е, для экзотермической реакции на величину теплоты эффекта, если рассматривают обратимый процесс (как в нашем примере). Для эндотермических реакций Е, не может быть равна нулю. Для экзотермической реакции Е, может быть равнв нулю.
В заключение сделаем вывод: многие возможные реакции практически ие идут, так как высока энергия активации.
Это имеет огромное значение для жизни. Представьте, что бы случилось, если бы псе термодинамически разрешенные реакции могли идти, не имея никакого энергетического барьера (энергии активации). Кислород воздуха прореагировал бы со всем, что может гореть или просто окисляться. «Пострадали» бы все органические вещества, они превратились бы в углекислый газ СО2 и воду Н20.
Таким образом, окружающий мир и мы сами существуем только благодаря наличию энергии активации, не позволяю-щей реакциям идти со значительной скоростью.
Скорость химической реакции зависит от многих факторов. Основными из них являются: природе н концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций.
Рассмотрим влияние каждого из этих факторов на скорость химической реакции.
Природа реагирующих веществ (их состав, строение)
Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Если энергия активации мала (- 40 кДж/моль), то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к их взаимодействию. и скорость такой реакции очень большая. Все реакции ионного обмена протекают практически мгновенно, ибо в этих реакциях участвуют разноименно заряженные ионы, и энергия активации в этих случаях ничтожно мала.
Если энергия активации велика ( - 120 кДж/моль). то это означает, что лишь ничтожная часть столкновений между действующими частицами приводит к реакции. Скорость такой реакции поэтому очень мала. Например, протекание реакции синтеза аммиака при обычной температуре заметить практически невозможно.
Если энергии активации химических реакций имеют промежуточные значения (40 * 120 кДж/моль), то скорости будут средними. К таким реакциям можно отнести взаимодействие натрии г водой или этиловым спиртом, обесцвечивание бромной воды этиленом, взаимодействие цинка с соляной кислотой и др.
Температура
Вам известно, что при повышении телгаературы в большинстве случаев скорость химической реакции значительно увеличивается.
В прошлом веке голландский химик Я. X. Вант-Гофф сформулировал правило:
Повышение температуры на каждые 10 °С приводит к увеличению скорости реакции в 2 4 раза (эти величину называют температурным коэффициентом реакции).
При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля активных молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции.
Однако для увеличения скорости реакции повышение температуры не всегда применимо, так как исходные вещества могут начать разлагаться, испаряться растворители или сами вещества и т. д.
Концентрации реагирующих веществ
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ.
Чтобы осуществилось химическое взаимодействие между какими-то частицами, они должны эффективно яолввутьоя. Чем больше концентрация реагирующих веществ, тем больше столкновении и соответственно скорость реакции. Например, в чистом кислороде ацетилен сгорает очень быстро. При этом развивается температура, достаточная для плавления металла. На основе большого экспериментального материала в 1867 г. норвежцами К. Гульдбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. Н. Бекетовым был сформулировав основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ:
Скорость химической реакции пропорциональна произведению концентраций реагирующих ее ществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон называют также законом действующих масс. Для реакции А + В — О этот закон выразится так:
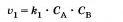

Н.Н.Бекетов (1827-1911)
Физический смысл константы скорости реакции нетрудно установить — она численно равна скорости реакции, в которой концентрации реагирующих веществ равны 1 моль/л или их произведение равно единице. В таком случае ясно, что константа скорости реакции зависит только от температуры и не зависит от концентрации веществ.
Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, так как они реагируют на поверхности и их концентрации обычно являются постоянными.
Если же уравнение реакции описывает лишь суммарную химическую реакцию, проходящую в несколько стадий, то скорость такой реакции может сложным образом зависеть от концентрации исходных веществ. Эта зависимость определяется экспериментально или теоретически на основании предполагаемого механизма реакции.
Действие катализаторов
Можно увеличить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей анергией активации. Их называют катализаторами (от лат. — разрушение).
Катализатор действует как опытный проводник, направляющий группу туристов не через высокий перевал в горах (его преодоление требует много сил и времени и не всем доступно), но известным ему обходным тропам, по которым можно преодолеть гору значительно легче и быстрее. Правда, по обходному пути можно попасть не совсем туда, куда ведет главный перевал. Но иногда именно это и требуется! Именно так действуют катализаторы, которые наливают селективными. Ясно, что нет необходимости сжигать аммиак в азот, зато оксид азота находит использование в производстве азотной кислоты.
Катализаторы — это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остающиеся неизменными качественно и количественно.
Различают два вида катализа.
Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся а одном агрегатном состоянии (фазе).
Гетерогенный катализ, при котором катализатор к реагирующие вещества находятся в разных фазах. Например, разложение пероксида водорода в присутствии твердого катализатора оксида марганца.
Как и в случае гомогенного катализа. При гетерогенном катализе реакция протекает через активные промежуточные комплексы.
Сам катализатор не расходуется в результате реакции, но если на его поверхности адсорбируются другие вещества (их называют каталитическими ядами), то поверхность становится нероботоспособной требуется регенерация катализатора. Поэтому перед проведением каталитической реакции тщательно очищают исходные вещества.
При производстве метанола используют твердый цинк.
Очень .эффективно работают биологические катализаторы — ферменты. Как вы помните, по химической природе это белки. Ьллюдяри им в живых организмах при невысокой температуре с большой скоростью протекает множество сложных химических реакций. Ферменты отличаются особой специфичностью, каждый из них ускоряет только свою реакцию, идущую в нужное время и в нужном месте с выходом, близким к 100%. Создание аналогичны* ферментам искусственных катал и заторов — мечта химиков!
Сравните эффективность фермента каталалы с другими катализаторами в процессе разложения Н2 й водном растворе по данным таблицы 13.
Вы, конечно, слышали и о других интересных веществах — ингибиторах (от лат. — задерживать). Они с высокой скоростью реагируют с активными частицами с образованием малоактивных соединений. В результате скорость реакции резко замедляется и она прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы.
Например, с помощью ингибиторов стабилизируют растворы пероксидя водорода, мономеры для предотвращения преждевременной полимерная цин. соляную кислоту, чтобы была возможна ее транспортировка в стальной таре. Ингибиторы содержатся и в живых организмах, они подавляют различные вредные реакции окисления в клетках тканей.

Поверхность соприкосновения реагирующих веществ
Скорость реакций, идущих иа поверхности веществ, то ость гетерогенных, зависит при щючих равных условиях от свойств зтой поверхности. Известно, что растертый в порошок мел гораздо быстрее растворяется в соляной кислоте, чем по массе кусочек мела.
Увеличение скорости реакции объясняется в первую очередь увеличением поверхности соприкосновения исходных веществ, в также рядом других причин, например нарушением структуры правильной кристаллической решетки. Это приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционнеспособнее, чем те же частицы на гладкой поверхности.
|




