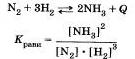Обратимость химических реакций. Химическое равновесие
Теперь вы знаете, что реакция может идти при благоприятном соотношении энергетического и энтропийного факторов. Но
если эти факторы уравновешивают друг друга, состояние системы не меняется. В таких случаях говорят, что система находится в равновесии.
Химические реакции, протекающие в одном направлении, называют необратимыми.
Большинство химических реакций являются обратимыми. Эта значит, что при одних и тех же условиях протекают и прямая, и обратная реакции (особенно если речь идет о замкнутых системах).
Taк как со временем концентрации веществ уменьшается, то и скорость прямой реакции тоже уменьшается.
Рано или поздно будет достигнуто состояние, при котором скорости прямой и обратной реакций станут равными V-> = <-V.
Состояние системы, при котором скорость прямой реакции равна скорости обратной рекции, называютхимическим равновесием.
При этом концентрации реагирующих веществ и продуктов реакции остаются без изменения. Их называют равновесными концентрациями. На макроуровне кажется, что в целом ничего не изменяется. Но на самом же деле в прямой, и обратный процесс продолжают идти, но с равной скоростью. Поэтому такое равновесие в системе называют подвижным или динамическим.
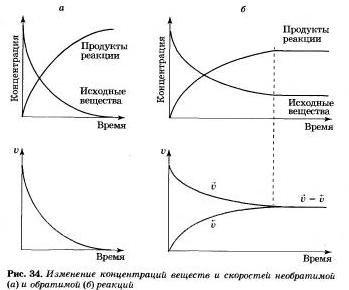
Разницу в изменении концентраций веществ и скорости реакции в случае необратимой и обратимой реакций вы можете увидеть на рисунке 34.
Константы равновесия рассчитывают из опытных данных, определяя равновесные концентрации исходных веществ и продуктов реакции при определенной температуре.
Значение константы равновесия характеризует выход продуктов реакции, полноту ее протекания. В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе.
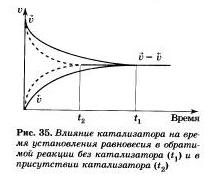
Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака:
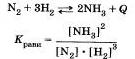
Влияние изменения концентрации веществ
При добавлении в реакционную смесь азота N2 и водорода H2 увеличивается концентрация газов, а значит, увеличивается скорость прямой реакции. Равновесие смещается вправо, в сторону продукта реакции, то есть в сторону аммиака.
Таким образом в реакционной смеси увеличится количество продукта реакции.
Увеличение же концентрации продукта реакции аммиака, приведет к смещению равновесия влево, в сторону образования исходных веществ. Этот вывод можно сделать на основании аналогичных рассуждений.
Влияние изменения давления
Изменение давления оказывает влияние только на те системы, где хотя бы одно из веществ находится в газообразном состоянии. При увеличении давления уменьшается объем газон, а значит, увеличивается их концентрация.
Предположим, что давление в замкнутой системе повысили, это значит, что концентрации всех газообразных веществ в рассматриваемой нами реакции возрастут в 2 раза.
Изменение давления практически не сказывается на объеме жидких и твердых веществ, то есть не изменяет их концентрацию. Следовательно, состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления.
Влияние изменения температуры
При повышении температуры, как вы знаете, скорости всех реакций (экзо и эндотермических) увеличиваются. Причем повышение температуры больше сказывается на скорости тех реакций, которые имеют большую энергию активации, а значит, эндотермических.
Таким образом, скорость обратной реакции (в нашем примере эндотермической) увеличится сильнее, чем скорость прямой. Равновесие сместится в сторону процесса, сопровождающегося поглощением энергии.
Направление смещения равновесия можно предсказать, пользуясь принципом Ле Шателье (1884 г.):
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смешается в ту сторону, которая ослабляет данное воздействие.

Анри Луи Ле-Шателье (1850-1936)
Сделаем выводы:
• при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
• при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
• при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
•при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
• при понижении температуры — в сторону экзотермического процесса.
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производство важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химического процесса, которые обеспечивают максимальный выход желаемого вещества.
1. В каком направлении сместится химическое равновесие в следующих системах: а) при понижении температуры; б) при оовышенни давления:
1)2СО + 2СO2 + Q 3)С2Н10 <->С4Н8+ Н2 - Q 2) N2+O2 <->2NO - Q
2. Как повлияет повышение давления ни химическое равновесие в следующих системах:
1) 2NO <-> N2O4 3) Нг2 + Вг2 <-> 2НВг
2) СО <-> Сl2 <-> СОСl2 4) СО + ЗНг <-> СН2 + Н2О(г)
3. Как надо изменить концентрации веществ, давление и температуру гомогенной системы
РСl5 <-> РСl3 + Сl2 - 129 кДж. чтобы сместить равновесие в сторону разложения РСl5?
4. В каком направлении сместится химическое равновесие системы 2СО + 2Н2 <-> СН4 + С02, если концентрации всех веществ уменьшить в 2 раза?
|