Понятие «атом» пришло к нам из далекой античности, но совершенно изменило тот первоначальный смысл, который вкладывали в него древние греки (в переводе с греческого «атом» означает «неделимый»). Этимология названия «неделимый» отражает сущность атома с точностью до наоборот. Атом делим и состоит из элементарных частиц.
Сложность строения атома доказана фундаментальными открытиями, сделанными в конце XIX и начале XX в. в результате изучения природы катодных лучей (Дж. Томсон, 1897 г.), открытия явления фотоэффекта (А. Г. Столетов, 1889 г.), открытия радиоактивности химических элементов (А. Беккерель, М. Склодовская-Кюри, 1896—1899 гг.), определения природы а-частиц (эксперименты Э. Резерфорда, 1889—1900 гг.).
Ученые пришли к заключению, что атомы обладают собственной структурой, имеют сложное строение.
Как же развивалась классическая теория строения атома?
Гипотеза Дж. Томсона о структуре атома — первая попытка объединить имевшиеся научные данные о сложном составе атома в «модель» атома.
В 1904 г. в работе «О структуре атома» Дж. Томсон дал описание своей модели, получившей образное название «сливового пудинга». В этой модели атом уподоблен сферической капле пудинга с положительным зарядом. Внутрь сферы вкраплены отрицательно заряженные «сливины»-электроны. Электроны совершают колебательные движения, благодаря которым атом излучает электромагнитную энергию. Атом в целом нейтрален.
Модель атома Дж. Томсона не была подтверждена экспериментальными фактами и осталась гипотезой.
Представления о составе атома и движении электронов в нем вошли в модель атома Э. Резерфорда.
Каков же атом в представлении Э. Резерфорда?
Планетарная модель атома Э. Резерфорда (1911 г.), согласно которой атом состоит из положительно заряженного ядра и электронов, вращающихся вокруг ядра по замкнутым орбитам подобно движению планет вокруг Солнца. Э. Резерфорд — основоположник современного учения об атоме — построил наглядную теоретическую модель атома, которой формально мы пользуемся и сейчас.
Классическая теория Резерфорда не могла объяснить излучение и поглощение энергии атомом.
Квантовые постулаты Н. Бора (1913 г.) внесли в планетарную модель атома Э. Резерфорда квантовые представления. Постулаты Н. Бора опирались на теоретические идеи М. Планка (1900 г.) и А. Эйнштейна(1905 г.).
Первый постулат. Электрон вращается вокруг ядра по строго определенным замкнутым стационарным орбитам в соответствии с «разрешенными» значениями энергии Ех, Е2, ..., Еn, при этом энергия не поглощается и не излучается.
Второй постулат. Электрон переходит из одного «разрешенного» энергетического состояния в другое, что сопровождается излучением или поглощением кванта энергии.
Бор внес квантовые представления в строение атома, но он использовал традиционные классические понятия механики, рассматривая электрон как частицу, движущуюся со строго определенными скоростями по строго определенным траекториям.
Его теория была построена на противоречиях. В 1932 г. была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов (11р) и нейтронов (01n).
Атом — электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
Электроны, протоны и нейтроны называют элементарными частицами.
Каковы же свойства этих частиц?
Корпускулярно-волновые свойства микромира. Элементарные частицы, а также построенные из них атомные ядра, атомы и молекулы имеют ничтожно малые массы и размеры и поэтому обладают своими особыми свойствами не похожими на те, которые имеют объекты окружающего нас макромира. Они образуют свой, специфический мир — микромир, который живет по особым законам, диктуемым квантовой механикой — наукой о строении и свойствах элементарных частиц, ядер, атомов и молекул, об их превращениях и явлениях, сопровождающих эти превращения.
Квантовая механика характеризует частицы микромира как объекты с двойственной природой — корпускулярно-вол-новым дуализмом-, они являются одновременно и частицами (корпускулами), и волнами.
Корпускулярно-волновой дуализм объектов микромира подтвержден и экспериментально знакомыми вам из курса физики интерференцией и дифракцией электронов, протонов, нейтронов, атомов и т. д.
Электрон — частица, определяющая наиболее характерные химические свойства атомов и молекул. Двойственная природа электрона может быть подтверждена на опыте. Если электроны, испускаемые источником, например катодом, пропускать через маленькие отверстия в пластинке, поставленной на их пути, то они, попадая на фотопластинку, вызывают ее почернение. После проявления фотопластинки на ней можно увидеть совокупность чередующихся светлых и темных колец, то есть дифракционную картину (рис. 1).
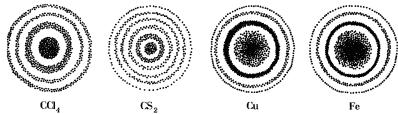
Рис. 1. Электронограммы газов (слева) и кристаллов (справа). Центральное пятно обусловлено нерассеянным пучком электронов, а кольца — электронами, рассеянными под разными углами
Дифракционная картина включает в себя как собственно дифракцию — огибание волной препятствия, так и интерференцию, то есть наложение волн друг на друга. Эти явления доказывают наличие у электрона волновых свойств, так как только волны способны огибать препятствия и налагаться друг на друга в местах их встречи. Однако, попадая на фотослой, электрон дает почернение лишь в одном месте, что свидетельствует о наличии у него корпускулярных свойств. Будь он только волной, он более или менее равномерно засвечивал бы всю пластинку.
Вследствие дифракции электрон, пройдя отверстие, может в принципе попасть в любую точку фотопластинки, но с разной вероятностью, то есть можно говорить о вероятности обнаружения электрона в той или иной области фотослоя, а в общем случае — в той или иной области пространства. Поэтому движение электрона и в атоме нельзя рассматривать как движение точечного заряда по строго определенной замкнутой траектории.
1. Назовите те явления, которые прямо или косвенно доказывают, что атом — сложная частица.
2. Как развивалась классическая теория строения атома? Какие модели атомов вам известны? В чем их суть? В чем — недостатки?
3. Приведите примеры явлений, доказывающих двойственную (дуалистическую) природу частиц микромира.
4. В чем отличие объектов микро- и макромира?
5. Под элементарными (наименьшими) частицами понимают неделимые частицы. Как такое допущение соответствует утверждению физиков о том, что элементарная атомная частица — электрон — делима? Кстати, именно открытие делимости электрона было удостоено Нобелевской премии в 1998 г.
| 


