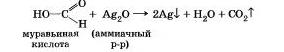Вы уже знаете немало определений кислот как класса сложных веществ.
Кислотами называют сложные вещества, которые состоят из атомов водорода, способных замещаться на металл, и кислотного остатка.
В свете теории электролитической диссоциации к кислотам относят электролиты, которые при диссоциации образуют катионы только одного типа — гидратированные ионы водорода.
Теория электролитической диссоциации объясняет кислотно-основные свойства водных растворов электролитов присутствием в них избытка ионов.
Наряду с этим известны реакции, в которых вещества взаимодействуют как кислота и основание при отсутствии в них ионов водорода и гидроксид-ионов. Вспомните, например, образование хлорида аммония при взаимодействии газообразных хлороводорода и аммиака, известное вам как дым без огня.
В 1923 г. появилась протолитическая теория кислот и оснований Брёнстеда—Лаур и, которая расширила представления о кислотах и основаниях, объяснила поведение веществ в водных и неводных (спиртовых, эфирных, аммиачиых) растворах. Согласно этой теории кислоты — это молекулы или ионы, которые являются в данной реакции донорами катионов водорода Н+ то есть отдают их.
Соответственно снования — это молекулы или ионы, которые прини мают катионы Н+, то есть являются акцепторами Н+.
С точки зрения этой теории распад электролита на ионы (I) и гидролиз по аниону (2) рассматривают как кислотно-основное взаимодействие электролитов и воды.
В реакции (1) Н20 ведет себя как основание — присоединяет протон (Н+) и образует ион оксония по донорно-акцепторному механизму.
Теперь, когда вы познакомились с более широким взглядом на ирнроду кислотно-основных свойств химических соединений, сделаем обобщение сведений о классе кислот, рассмотрев классификацию и свойства неорганических и органических кислот (табл. 17).
Свойства кислот
Кислый вкус, действие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
HCl = H+ + Cl-

Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли.
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимые соли.
4. И те и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовать как средние, так и кислые соли (это реакции нейтрализации)
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ.
6. Сложные эфиры образуют не только органические кислоты согласно общему уравнению.
Аналогичная реакция с ушетием двух и трех гидроксо-групп целлюлозы при ее нитровании приводит к получению сложных зфиров: ли- и тринитроцеллюлозы — очень необходимых веществ для производства бездымного пороха.
Вместе с тем отдельные представители минеральных и органических кислот имеют и особые свойства.
Уксусная кислота СН3СО0Н, как и другие карбоновые кислоты, содержит в молекуле углеводородный радикал. В нем возможны реакции замещения водорода галогенами:
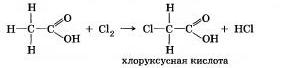
Под влиянием атомов галогена в молекуле кислоты ее степень диссоциации сильно повышается. Например, хлоруксус-няя кислота почти в 100 раз сильнее уксусной (почему?).
Муравьиная кислота НСООН. в отлмчие от уксусной, не имеет в молекуле углеводородного радикала. Вместо него она содержит атом водорода, а потому является веществом с двойственной функцией — альдегидокислотой и. в отличие от других карбоновых кислот, дает реакцию «серебряного зеркала». Образующаяся угольная кислота Н2С03 распадается на воду и углекислый газ.
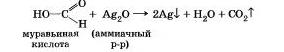
1. Как природа кислоты влияет на степень электролитической диссоциации? Рассмотрите это влияние на примерах: а) азотной и азотистой кислот, б) хлорноватистой НСlO и хлорной НСl04. d) сернистой и серной кислот. Сделайте общий вывод.
2. Рассмотрите взаимное влияние атомов в молекуле пропановой кислоты СН3—СН2—СООН по плану: а) влияние радикала на карбоксил; б) влияние карбоксила на радикал; в) влияние карбоннла на гидрокенл; г) влияние гидроксила на карбонил.
3. Расположите хлорпронзводные уксусной кислоты в порядке увеличения их силы. Объясните ответ.
4. Почету азотная и серная (конц.) кислоты ведут себя в реакциях с металлами иначе, чем, например, соляная?
8. В 730 г 12%-ной соляной кислоты растворили 33.б л хлороводородов. Найдите массовую долю хлороподорода в полученном растворе.
Ответ: 18.14%.
9. В 820 г 0.5%-ного раствора сернистой кислоты растворили еще 11.2л сернистого газа. Какой стала массовая доля кислоты в полученном растворе?
Ответ: 5.29%.
|