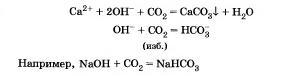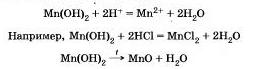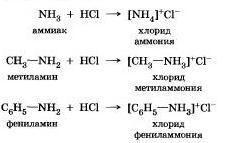На каждом этапе развития ваших химических знаний основания, как и кислоты, вы определяли по-разному.
Основания — это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими гидроксогруппами (в зависимости от степени окисления металла).
С точки зрения теории электролитической диссоциации основания — это электролиты, которые при диссоциации образуют в качестве отрицательных ионов только гидроксиданионы.
Наконец, в свете протолитической теории Брёнстеда—Лоури основания — это молекулы или ионы, которые служат акцепторами катионов водорода Н+ (протонов).
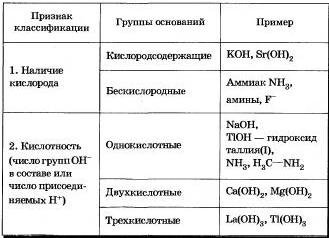
Последнее определение более полное, так как оно позволяет включить в класс оснований фторид-ион, аммиак, амины и другие вещества, которые оказались бы за рамками этого класса, если опираться на первое и второе определения. Классификация оснований по различным признакам дана в таблице 19.
Таблица 19 Классификации оснований

Характеризуя свойства оснований, мы рассмотрим отдельно свойства гидроксидов металлов — кислородсодержащих оснований, причем особо выделим свойства щелочей.
Химические свойства оснований
Свойства щелочей — гидроксидов щелочных н щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, разъедают кожу, ткань, изменяют окраску индикаторов: лакмуса — в синий, фенолфталеина — в малиновый.
2. Водные растворы основании (растворимых) диссоциируют.
3. Взаимодействуют с кислотами, вступая с ними в реакцию обмена.
Многокислотные основании могут в таких реакциях давать как средние, так и основные соли.
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли а зависимости от основности кислоты, соответствующей этому оксиду:
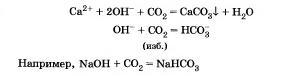
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
а) при сплавлении (термическая диссоциация)
б) в растворах
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ.
7. Вступают в реакции с некоторыми органическими веществами, например с фенолом — карболовой кислотой.
Нерастворимые основания взаимодействуют с кислотами и разлагаются при нагревании на основный оксид и воду.
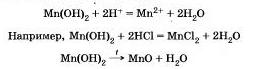
Свойства бескислородных оснований
Рассмотрим их на примере аммиака и аминов
1. Взаимодействуют с кислотами, образуя соли но донорно-акцепторному механизму:
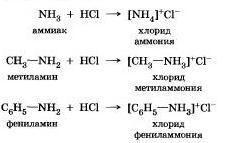
2. Взаимодействуют с водой, образуя гидроксиды — слабые и непрочные кислородсодержащие основания
Основные свойства метиламина выражены более сильно, чем у аммиака, потому что положительный индукционный эффект метального радикала — СН3 увеличивает электронную плотность на атоме азота, обеспечивая тем самым его большую способность к присоединению протона.
Водные растворы аммиака и аминов имеют щелочную среду и окрашивают фенолфталеин в малиновый цвет. Анилин такого действия не оказывает.
Ароматические амины плохо растворяются в воде. Их основные свойства ослаблены влиянием бензольного кольца, которое несколько оттягивает неподеленную электронную пару от атома азота аминогруппы, вследствие чего затрудняется прием протонов Н+.
Аммиак, метиламин и анилин можно расположить в следующий ряд в порядке ослабления их основных свойств.
На этом примере, одном из многих, мы опять красноречиво подтверждаем универсальное проявление положения теории химического строений о взаимном влиянии атомов в молекулах веществ.
Влияние аминогруппы на бензольное ядро (радикал фенил) из-за наличия на атоме азота неподеленной электронной пары приводит к нарушению равномерности распределения замкнутой п-электронной системы в бензольном кольце, вследствие чего атомы водорода будут более подвижными в 2. 4, 6-положениях.
По этой причине реакции замещения в бензольном кольце будут проходить в этих положениях.
Многие амины с низкой молекулярной массой имеют неприятный запах испорченной рыбы, ведь они и аммиак образуются при разложении мертвых организмов без доступа кислорода.
Некоторые лекарственные препараты (белый стрептоцид, норсульфазол, сульфидин) — производные ароматических аминов.
1. Почему фенол откосят к кислотам, а анилин — к основаниям? Что общего во влиянии гидроксо- и аминогрупп на фенил? На примере этих веществ рассмотрите положение теории А. М. Бутлерова о взаимном влиянии атомов в молекулах.
3. Как изменяются основные свойства летучих водородных соединении в пределах одного периода? Рассмотрите на примере соединений элементов второго периода. Поясните ответ.
4. Как изменяются основные свойства летучих водородных соединений одной подгруппы? Почему? Рассмотрите на примере соединений элементов главной подгруппы V группы. Поясните ответ.
5. Найдите массовую долю гидроксида натрия в растворе, полученном при взаимодействии 69 г натрия и 130 мл воды. Ответ: 61,2%.
6. В 400 г 5%-иого раствора гидроксида натрия добавили 92 г натрия. Какой стала массовая доле щелочи в полученном растворе?
Ответ: 37.10%.
7. Рассчитайте объем метиламина (н. у.), необходимого для получен на 16,2 г хлорида метилакмония. если его выход составил 80% от теоретически возможного. Ответ: 6.72 л.
|