Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, то есть можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
На рисунке 2 показан «разрез» такой электронной плотности в атоме водорода, проходящий через ядро, а штриховой линией ограничена сфера, внутри нее вероятность обнаружения электрона составляет 90%. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона -10%, вероятность же обнаружения электрона внутри второго от ядра контура составляет -20%, внутри третьего — -30% и т. д. В состоянии электрона есть какая-то неопределенность. Чтобы охарактеризовать это особое состояние, немецкий физик В. Гейзенберг ввел понятие о принципе неопределенности, то есть показал, что невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее будет его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона будет максимальной.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
В нем заключено приблизительно 90% электронного облака, и это означает, что около 90% времени электрон находится в этой части пространства. По форме различают 4 известных ныне типа орбиталей, которые обозначают латинскими буквами s, р, d, f. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке 3.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра: 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И.Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода — один энергетический уровень, второго периода — два, седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле
N = 2n2,
где N — максимальное число электронов; n — номер уровня или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов-,
• на втором — не более 8;
• на третьем — не более 18;
• на четвертом — не более 32.
А как, в свою очередь, устроены энергетические уровни (электронные слои)?
Начиная со второго энергетического уровня (n = 2), каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй — два; третий — три; четвертый — четыре подуровня. Подуровни, в свою очередь, образованы орбиталями.
Каждому значению п соответствует число орбиталей, равное n2. По данным, представленным в таблице 1, можно проследить связь главного квантового числа п с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Таблица 1 Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях
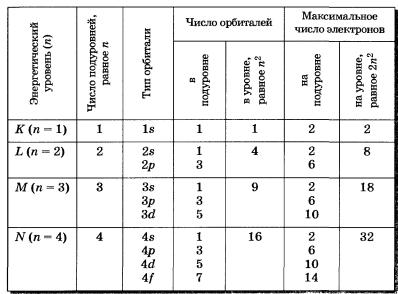
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, р, d, f.
s-Подуровень — первый, ближайший к ядру атома подуровень каждого энергетического уровня, состоит из одной s-орбитали;
р-подуровень — второй подуровень каждого, кроме первого, энергетического уровня, состоит из трех р-орбиталей;
d-подуровень — третий подуровень каждого, начиная с третьего, энергетического уровня, состоит из пяти d-орбиталей;
f-подуровень каждого, начиная с четвертого, энергетического уровня, состоит из семи f-орбиталей.
На рисунке 4 представлена схема, отражающая число, форму и положение в пространстве электронных орбиталей первых четырех электронных слоев отдельного атома.
1. В настоящее время не принято говорить о вращении электрона вокруг атомного ядра. Почему?
2. Что такое электронное облако и как это понятие соотносится с понятием "орбиталь"?
3. Как с помощью электролиза определить заряд электрона?
4. Чем отличается 1s-орбиталь от 2s-орбитали?
5. Что такое главное квантовое число? Как оно соотносится с номером периода?
6. Что такое подуровень и как это понятие соотносится с номером периода?
|



