Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского «веретено»), то есть обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемой оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, то есть электроны с противоположными спинами.
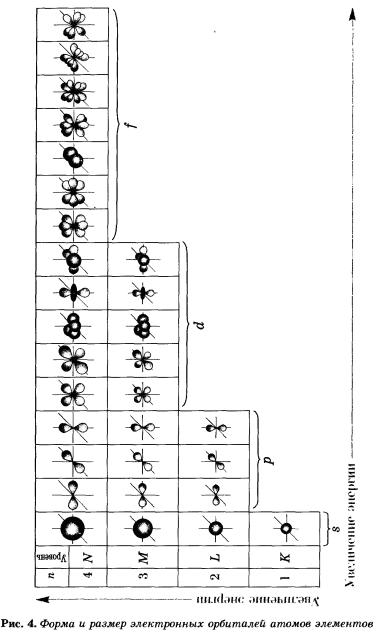
На рисунке 5 показана схема подразделения энергетических уровней на подуровни.
s-Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода (s = 1) располагается на этой орбитали и неспарен. Поэтому его электронная формула или электронная конфигурация будет записываться так: 1s1. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой (1 ...), латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа вверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной s-орбитали, эта формула: 1s2.
Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ.
На втором энергетическом уровне (n = 2) имеется четыре орбитали: одна s и три р. Электроны s-орбитали второго уровня (2s-орбитали) обладают более высокой энергией, так как находятся на большем расстоянии от ядра, чем электроны 1s-орбитали (n = 2).
Вообще, для каждого значения n существует одна s-орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения n.
р-Орбиталь имеет форму гантели или объемной восьмерки. Все три р-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с n = 2, имеет три р-орбитали. С увеличением значения n электроны анимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям х, у, г.
У элементов второго периода (n = 2) заполняется сначала одна в-орбиталь, а затем три р-орбитали. Электронная формула 1л: 1s22s1. Электрон слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион Li+.
В атоме бериллия Ве0 четвертый электрон также размещается на 2s-орбитали: 1s22s2. Два внешних электрона атома бериллия легко отрываются — Ве0 при этом окисляется в катион Ве2+.
У атома бора пятый электрон занимает 2р-орбиталь: 1s22s22р1. Далее у атомов С, N, О, Е идет заполнение 2р-орбиталей, которое заканчивается у благородного газа неона: 1s22s22р6.
У элементов третьего периода заполняются соответственно Зв- и Зр-орбитали. Пять d-орбиталей третьего уровня при этом остаются свободными:
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно 4я- и 5я-орбитали: 19К 2, 8, 8, 1; 38Sr 2, 8, 18, 8, 2. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие 3d- и 4d- орбитали соответственно (у элементов побочных подгрупп): 23V 2, 8, 11, 2; 26Tr 2, 8, 14, 2; 40Zr 2, 8, 18, 10, 2; 43Тг 2, 8, 18, 13, 2. Как правило, тогда, когда будет заполнен предыдущий d-подуровень, начнет заполняться внешний (соответственно 4р- и 5р ) р-подуровень.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступят на внешний в-подуровень: 56Ва 2, 8, 18, 18, 8, 2; 87Гг 2, 8, 18, 32, 18, 8, 1; следующий один электрон (у Nа и Ас) на предыдущий (p-подуровень:57Lа 2, 8, 18, 18, 9, 2 и 89Ас 2, 8, 18, 32, 18, 9, 2.
Затем последующие 14 электронов поступят на третий снаружи энергетический уровень на 4f- и 5f-орбитали соответственно у лантаноидов и актиноидов.
Затем снова начнет застраиваться второй снаружи энергетический уровень (d-подуровень): у элементов побочных подгрупп: 73Та 2, 8,18, 32,11, 2; 104Rf 2, 8,18, 32, 32,10, 2, — и, наконец, только после полного заполнения десятью электронами сйгоду-ровня будет снова заполняться внешний р-подуровень:
86Rn 2, 8, 18, 32, 18, 8.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.
В заключение еще раз рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И.Менделеева. Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
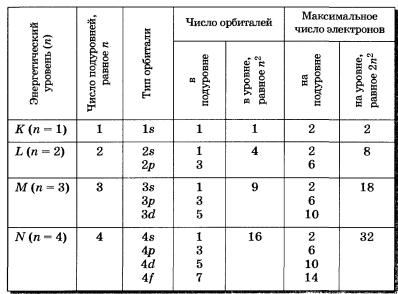
В атоме гелия первый электронный слой завершен — в нем 2 электрона.
Водород и гелий — s-элементы, у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен и электроны заполняют е- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s-, а затем р ) и правилами Паули и Хунда (табл. 2).
В атоме неона второй электронный слой завершен — в нем 8 электронов.
Таблица 2 Строение электронных оболочек атомов элементов второго периода

Окончание табл. 2
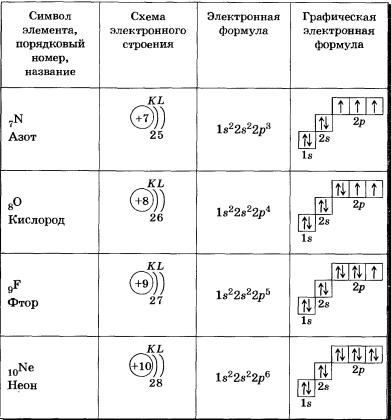
Li, Ве — в-элементы.
В, С, N, О, F, Nе — р-элементы, у этих атомов заполняются электронами р-орбитали.
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать Зs-, 3р- и Зd-подуровни (табл. 3).
Таблица 3 Строение электронных оболочек атомов элементов третьего периода
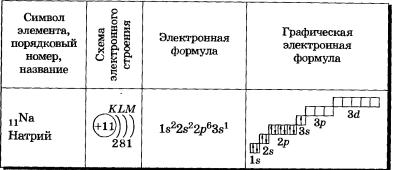
У атома магния достраивается Зs-электронная орбиталь. Nа и Mg— s-элементы.

В атоме аргона на внешнем слое (третьем электронном слое) 8 электронов. Как внешний слой, он завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными Зd-орбитали.
Все элементы от Аl до Аг — р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень (табл. 4), так как он имеет меньшую энергию, чем Зй-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода: 1) обозначим условно графическую электронную формулу аргона так:
Аr;
2) не будем изображать подуровни, которые у этих атомов не заполняются.
Таблица 4 Строение электронных оболочек атомов элементов четвертого периода

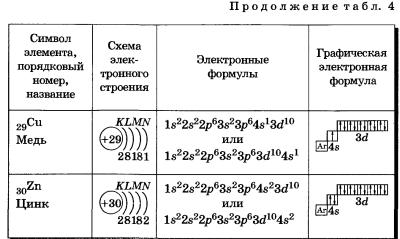
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sс до Zn заполняется электронами Зй-подуровень. Это Зй-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4я- на Зй-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций Зd5 и Зd10:

В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, Зр и Зd, всего на них 18 электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень: Элементы от Gа до Кr — р-элементы.
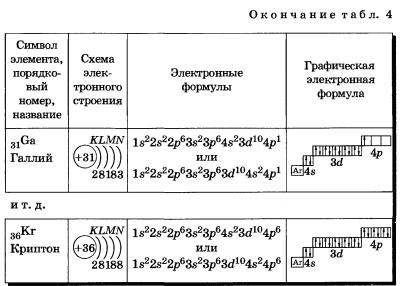
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое, как вы знаете, может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f- подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s-> 4d -> 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42MO и т.д.
В шестом и седьмом периодах появляются элементы, то есть элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-Элементы называют лантаноидами.
5f-Элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Сs и 56Ва — 6s-элементы;
57Lа... 6s25d1 — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf — 80Нg — 5d-элементы; 81Тl— 86Rn — 6р-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f подуровней, то есть nf7 и nf14.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства или блока (рис. 7).
1) s-Элементы; заполняется электронами в-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р элементам относятся элементы главных подгрупп III—VIII групп;
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, то есть элементы вставных декад больших периодов, расположенные между s- и р-элементами. Их также называют переходными элементами;
4) f-элементы, заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
1. Что было бы, если бы принцип Паули не соблюдался?
2. Что было бы, если бы правило Хунда не соблюдалось?
3. Составьте схемы электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Са, Fе, Zr, Sn, Nb, Hf, Ра.
4. Напишите электронную формулу элемента № 110, используя символ соответствующего благородного газа.
5. Что такое «провал» электрона? Приведите примеры элементов, у которых это явление наблюдается, запишите их электронные формулы.
6. Как определяется принадлежность химического элемента к тому или иному электронному семейству?
7. Сравните электронную и графическую электронную формулы атома серы. Какую дополнительную информацию содержит последняя формула?
|












