Валентные возможности атомов химических элементов Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоев.
Для того чтобы верно оценить валентные возможности атомов химических элементов, нужно рассмотреть распределение электронов в них по энергетическим уровням и подуровням и определить число неспаренных электронов в соответствии с принципом Паули и правилом Хунда для невозбужденного (основного, или стационарного) состояния атома и для возбужденного (то есть получившего дополнительную энергию, в результате чего происходит распаривание электронов внешнего слоя и переход их на свободные орбитали). Атом в возбужденном состоянии обозначают соответствующим символом элемента со звездочкой. Например, рассмотрим валентные возможности атомов фосфора в стационарном и возбужденном состояниях:
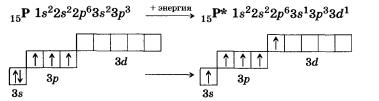
В невозбужденном состоянии атом фосфора имеет три не-спаренных электрона на р-подуровне. При переходе атома в возбужденное состояние один из пары электронов d-подуровня может переходить на свободную орбиталь d-подуровня. Валентность фосфора при этом изменяется с трех (в основном состоянии) до пяти (в возбужденном состоянии).
Разъединение спаренных электронов требует затрат энергии, так как спаривание электронов сопровождается понижением потенциальной энергии атомов. Вместе с тем расход энергии на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химических связей неспаренными электронами.
Так, атом углерода в стационарном состоянии имеет два неспаренных электрона. Следовательно, с их участием могут образоваться две общие электронные пары, осуществляющие две ковалентные связи. Однако вам хорошо известно, что во многих неорганических и во всех органических соединениях присутствуют атомы четырехвалентного углерода. Очевидно, что его атомы образовали четыре ковалентные связи в этих соединениях, находясь в возбужденном состоянии.
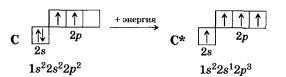
Затраты энергии на возбуждение атомов углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных ковалентных связей. Так, для перевода атомов углерода из стационарного состояния 2s22р2 в возбужденное — 2s12р3 требуется затратить около 400 кДж/моль энергии. Но при образовании С—Н-связи в предельных углеводородах выделяется 360 кДж/моль. Следовательно, при образовании двух молей С—Н-связей выделится 720 кДж, что превышает энергию перевода атомов углерода в возбужденное состояние на 320 кДж/моль.
В заключение следует отметить, что валентные возможности атомов химических элементов далеко не исчерпываются числом неспаренных электронов в стационарном и возбужденном состояниях атомов. Если вы вспомните донорно-ак-цепторный механизм образования ковалентных связей, то вам станут понятны и две другие валентные возможности атомов химических элементов, которые определяются наличием свободных орбиталей и наличием неподеленных электронных пар, способных дать ковалентную химическую связь по донор-но-акцепторному механизму. Вспомните образование иона аммония NH4+. (Более подробно мы рассмотрим реализацию этих валентных возможностей атомами химических элементов при изучении химической связи.)
Сделаем общий вывод.
Валентные возможности атомов химических элементов определяются: 1) числом неспаренных электронов (одноэлектронных орбиталей); 2) наличием свободных орбиталей; 3) наличием неподеленных пар электронов.
1. Какими тремя факторами определяются валентные возможности атомов химических элементов?
2. Почему максимальная валентность атомов элементов второго периода не может быть больше четырех?
3. Вспомните, чем отличаются понятия валентности и степени окисления. Что между ними общего?
4. Укажите валентность и степень окисления атомов азота в ионе аммония NH4+.
5. Определите валентность и степень окисления атомов углерода в веществах с формулами С2Н6, С2Н4, С2Н2.
6. Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Н202, ОF2, 02F2.
7. Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях.
| 



