Гибридизация электронных орбиталей и геометрия молекул Ковалентная связь наиболее распространена в мире органических и неорганических веществ и характеризуется насыщаемостью, поляризуемостью и направленностью в пространстве.
Насыщаемость ковалентной связи состоит в том, что число общих электронных пар, которые способен образовать тот или иной атом, ограничено. Благодаря этому ковалентные соединения имеют строго определенный состав. Поэтому, например, существуют молекулы Н2, N2, СН4, но нет молекул Н3, N4, СН5.
Поляризуемость ковалентной связи заключается в способности молекул (и отдельных связей в них) изменять свою полярность под действием внешнего электрического поля.
В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы — превратиться в еще более полярные вплоть до полного разрыва отдельных связей с образованием ионов:
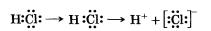
Направленность ковалентной связи обусловлена тем, что р-, d и f орбитали определенным образом ориентированы в пространстве. Направленность ковалентной связи влияет на форму молекул веществ, их размеры, межатомные расстояния, валентный угол, то есть на геометрию молекул.
В результате образования ковалентной связи атомы неметаллов получают завершенную электронную конфигурацию внешнего слоя из восьми электронов. Получившиеся при этом четыре электронные пары располагаются в пространстве из-за взаимного отталкивания так, чтобы быть максимально удаленными друг от друга. Ученые рассчитали, что наибольшее расстояние между четырьмя электронными парами достигается при их тетраэдриче-ском расположении, то есть тогда, когда каждая из четырех электронных пар занимает область пространства, направленную к одной из вершин тетраэдра.
Например, в молекуле метана СН4 атом углерода получил «заветный» октет электронов за счет образования четырех общих электронных пар с четырьмя атомами водорода.
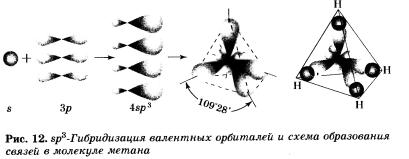
Атом углерода, как вы помните из курса органической химии, расположен в центре тетраэдра, а атомы водорода — в четырех вершинах. Угол Н—С—Н будет равен 109°28' (рис. 10).
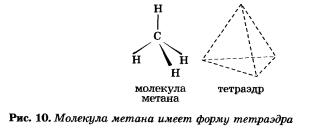
Аналогичное тетраэдрическое расположение имеют и связи атомов углерода в молекулах других алканов, например в молекуле этана.
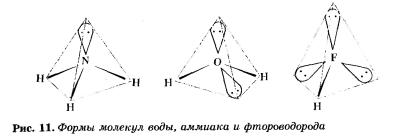
В молекуле метана все четыре общие электронные пары образовались за счет спаривания непарных электронов атома углерода с четырьмя электронами четырех атомов водорода — в ней нет не-поделенных электронных пар. А вот, например, в молекулах аммиака NH3, воды Н20 и фтористого водорода НF, во внешнем электронном слое атомов азота, кислорода и фтора они имеются (у азота — одна электронная пара, у кислорода — две, и у фтора — три).
Эти неподеленные электронные пары отталкивают общие электронные пары, и поэтому в молекулах аммиака, воды и фторо-водорода связи стремятся также принять тетраэдрическую направленность, но только в одной (NН3), двух (Н20) и трех (НF) вершинах этих тетраэдров будут располагаться неподеленные электронные пары (рис. 11).
Следовательно, форма молекул с ковалентными связями определяется несложной закономерностью:
электронные пары завершенного внешнего слоя отталкиваются друг от друга и стремятся расположиться на максимальных расстояниях друг от друга.
Неподеленные электронные пары сильнее отталкивают от себя общие электронные пары о-связей, чем эти пары отталкивают друг друга. Этим объясняется уменьшение углов связей по сравнению с тетраэдрическим углами (109°28') в ряду:

Более полное представление о форме молекул органических и неорганических веществ можно составить на основе гипотезы о гибридизации электронных орбиталей атомов. Она была предложена Л. Полингом (США) для объяснения установленного с помощью новых физических методов исследования веществ факта равноценности всех химических связей и симметричного расположения их относительно центра молекул СН4, ВF3, ВеСl2. В образовании о-связей в каждом случае от центрального атома (С, В, Ве) должны были участвовать орбитали разных типов (s- и р), поэтому они не могли быть равноценными. Теория оказалась неспособной объяснить факты, возникло противоречие, которое было разрешено с помощью новой гипотезы. Это один из примеров, показывающих путь развития познания человеком окружающего мира, возможность все более глубокого проникновения в сущность явлений.
С гипотезой гибридизации электронных орбиталей вы знакомились в курсе органической химии на примере атома углерода. Напомним об этом еще раз.
При образовании молекулы метана СН4 атом углерода из основного состояния переходит в возбужденное:
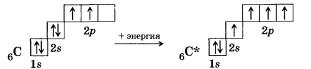
Внешний электронный слой возбужденного атома углерода содержит один в- и три р-неспаренных электрона, которые и дадут четыре о-связи с четырьмя s-электронами атомов водорода. При этом следует ожидать, что три связи С—Н, образованные за счет спаривания трех р-электронов атома углерода с тремя s-электронами трех атомов водорода (s—р гамма-связь), должны бы отличаться от четвертой (s—s) связи прочностью, длиной, направленностью. Изучение электронной плотности в молекулах метана показывает, что все связи в молекуле метана равноценны и направлены к вершинам тетраэдра. Это объясняется тем, что при образовании молекулы метана четыре ковалентные связи возникают не за счет «чистых» орбиталей, а за счет так называемых гибридных, то есть усредненных по форме и размерам (а следовательно, и по энергии), орбиталей.
Гибридизацией электронных орбиталей называют процесс их взаимодействия, приводящий к выравниванию по форме и энергии.
Число гибридных орбиталей равно числу исходных орбиталей. Гибридные орбитали выгоднее по геометрической форме, чем s- и р-орбитали, их электронная плотность распределена иначе, что обеспечивает более полное перекрывание с в-орбиталями атомов водорода, чем было бы у «чистых» s- и р-орбиталей.
В молекуле метана и в других алканах, а также во всех органических молекулах по месту одинарной связи атомы углерода находятся в состоянии sр3-гибридизации, то есть у атома углерода гибридизации подверглись одна s- и три р-орбитали и образовались четыре одинаковые гибридные вр3-орбита-ли.
В результате перекрывания четырех гибридных sр3-орби-талей атома углерода и в орбиталей четырех атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми гамма-связями под углом в 109°28' (рис. 12).
Этот тип гибридизации атомов и, следовательно, тетраэдрическое строение будет характеризовать также молекулы соединений аналога углерода — кремния: SiН4, SіСl4.
А в молекулах воды и аммиака происходит sр3-гибридизация орбиталей атомов кислорода и азота. Однако если у атома углерода все четыре гибридные sр3-орбитали заняты общими электронными парами, то у атома азота одна ер-орбиталь занята неподеленной электронной парой, а у атома кислорода ими заняты уже две sр3-орбитали.
Таким образом, на изменение величины угла связей в тетраэдре (109°28') оказывают действие отталкивающие свойства неподеленных (свободных) электронных пар, занимающих гибридные sр3-орбитали: у атома азота одна электронная пара (< Н—N—Н = 107°30'), а у атома кислорода — две (< Н—О—Н = 104°27').
sр3-Гибридизация наблюдается не только у атомов в сложных веществах, но и у атомов в простых веществах. Например, у атомов такой аллотропной модификации углерода, как алмаз.
В молекулах некоторых соединений бора имеет место sр2-гибридизация внешних орбиталей атома бора.
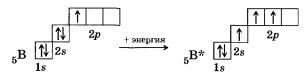
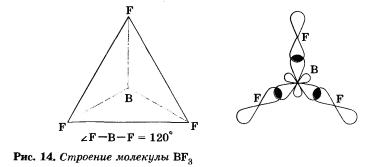
У атома бора в возбужденном состоянии в гибридизации участвуют одна изs- и две р-орбитали, в результате чего образуются три §р2-гибридные орбитали, расположенные в плоскости под углом 120° друг к другу (рис. 13).
Поэтому молекулы таких соединений, например ВF3, имеют форму плоского треугольника (рис. 14).
В органических соединениях, как вы знаете, sр2-гибридизация характерна для атомов углерода в молекулах алкенов по месту двойной связи, чем и объясняется плоскостное строение этих частей молекул, а также молекул диенов и аренов. sр2-Гибридизация наблюдается также у атомов углерода и в такой аллотропной модификации углерода, как графит.
В молекулах некоторых соединений бериллия наблюдаетсяsр-гибридизация внешних орбиталей возбужденного атома бериллия.
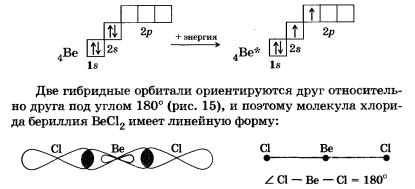
Аналогичный тип гибридизации электронных орбиталей существует у атомов углерода в алкинах — углеводородах ряда ацетилена — по месту тройной связи.
Такая гибридизация орбиталей характерна для атомов углерода в еще одной его аллотропной модификации, карбине:
...-С-= С -С-=С- ...
В таблице 8 приведены виды геометрических конфигураций молекул, соответствующие некоторым типам гибридизации орбиталей центрального атома А с учетом влияния числа свободных (несвязывающих) электронных пар.
Таблица 8 Геометрические конфигурации молекул, соответствующие различным типам гибридизации — внешних электронных орбиталей центрального атома
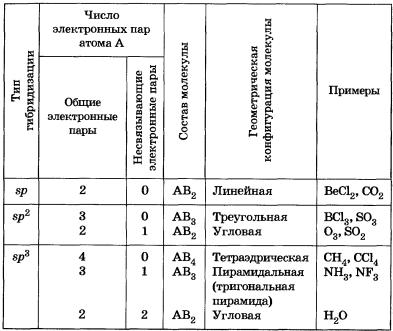
1. В молекулах водородных соединений углерода, азота и кислорода СН4, NН3 и Н20 валентные орбитали центральных атомов неметаллов имеют одинаковое состояние sр3-гибридизации, но разные углы между связями — 109°28', 107°30' и 104°27' соответственно. Чем это можно объяснить?
2. Почему графит электропроводен, а алмаз нет?
3. Какую геометрическую форму будут иметь молекулы двух фторидов — бора и азота (ВF3 и NF3 соответственно)? Дайте обоснованный ответ.
4. Молекула фторида кремния SiF4 имеет тетраэдрическое строение, а молекула хлорида брома ВСl3 — форму треугольника — плоскостное. Почему?
| 










